Металлы – это особый класс элементов, которые обладают высокой активностью и широким спектром применения. Их активность зависит от множества факторов, которые влияют на химические и физические свойства этих веществ. Процессы изменения активности металлов включают в себя различные химические реакции, окисление и восстановление, а также взаимодействие с другими элементами.
Одним из факторов, влияющих на активность металлов, является их электрохимический потенциал. Электрохимический потенциал – это мера способности металла перейти в оксидированное или восстановленное состояние. Чем выше электрохимический потенциал, тем большую активность проявляет металл. Например, металлы с положительным электрохимическим потенциалом, такие как алюминий и железо, легко окисляются, а металлы с отрицательным потенциалом, такие как медь и серебро, проявляют большую восстанавливающую способность.
Важным фактором, влияющим на активность металлов, является их растворимость. Растворимость металлов в различных средах определяет их способность взаимодействовать с другими веществами. Например, некоторые металлы, такие как золото и платина, обладают низкой растворимостью и, следовательно, проявляют меньшую активность. В то же время, металлы с высокой растворимостью, например, натрий и калий, обладают высокой активностью и широко используются в промышленности и повседневной жизни.
Окружающая среда также оказывает значительное влияние на активность металлов. Например, влажная среда способствует коррозии металлов, что ведет к их разрушению и понижению активности. Температура также играет важную роль – некоторые металлы проявляют большую активность при высоких температурах, в то время как другие становятся менее активными или полностью теряют свои химические свойства.
В целом, процессы изменения активности металлов очень сложны и зависят от множества факторов. Понимание этих процессов является важной задачей как для научных исследований, так и для практического применения металлов в различных областях жизни.
Влияние физических процессов

Физические процессы оказывают значительное влияние на активность металлов. Одним из факторов, влияющих на активность металлов, является их структура. Кристаллическая решетка металла определяет его химические и физические свойства. Металлы с более компактной и упорядоченной структурой обычно обладают высокой активностью.
Также физические процессы, такие как тепловая обработка и механическая обработка, могут изменить активность металлов. Нагревание металла может вызывать его окисление и образование пленки оксида на поверхности, что может повлиять на его активность. Механическая обработка, такая как прокатка или изгиб, может изменять структуру металла и его поверхность, что также может оказывать влияние на его активность.
Физические процессы также могут изменять размеры и форму металлических частиц, что может оказать влияние на их активность. Маленькие металлические частицы обычно обладают более высокой активностью, поскольку у них большая поверхность в соотношении к объему. Большая поверхность позволяет большему количеству реагентов контактировать с металлом, что может увеличить его активность.
Кроме того, физические процессы, такие как осаждение или нанесение тонких пленок на поверхность металла, могут изменить активность металла. Эти пленки могут предоставить защитную оболочку, которая может предотвратить окисление металла и сохранить его активность.
Температура, давление, среда

Температура, давление и среда - важные факторы, влияющие на активность металлов. Изменение этих параметров может значительно повлиять на процессы, происходящие с металлом.
Температура является одним из основных факторов, определяющих скорость химических реакций. Повышение температуры обычно увеличивает скорость реакции, так как повышение температуры повышает энергию частиц. Для некоторых металлов, таких как алюминий или медь, повышение температуры может ускорить их окисление.
Давление также может влиять на активность металлов. Некоторые металлы, например, водород, могут образовывать соединения при высоких давлениях. Изменение давления может изменить реакционную способность металла и степень его окисления или восстановления.
Среда, в которой находится металл, также играет важную роль. Окружающая среда может содержать различные химические вещества, которые могут реагировать с металлами. Например, в кислой среде некоторые металлы, такие как цинк или железо, реагируют с кислородом и образуют окисленные соединения.
Таким образом, температура, давление и среда являются факторами, важными для понимания активности металлов. Изменение этих параметров может привести к различным реакциям и процессам, определяющим поведение металла.
Роль химических реакций

Химические реакции играют важную роль в процессах изменения активности металлов. Они могут влиять на активность металлов, происходящую при контакте с другими веществами или средой.
При химической реакции осуществляется обмен электронами между атомами металла и другими веществами. Это может приводить к изменению валентности металла или образованию новых соединений. Изменение степени окисления металла может влиять на его активность.
Некоторые химические реакции могут способствовать ускорению процессов коррозии металлов. Например, взаимодействие металла с кислотой может приводить к образованию солей и выделению газов, что усиливает разрушительное воздействие на металлическую поверхность.
Однако химические реакции также могут использоваться для защиты металлов от коррозии. Например, проведение электрохимической реакции, при которой металл выступает в качестве анода, может способствовать формированию пассивной оксидной пленки на его поверхности, которая предотвращает дальнейшую коррозию.
В некоторых случаях, химические реакции могут изменять активность металлов путем образования комплексных соединений. Например, взаимодействие металла с органическими веществами может приводить к образованию стабильных комплексов, что может снижать активность металла и повышать его устойчивость к реакциям окисления и коррозии.
Окисление, взаимодействие с кислотой, образование соединений

Окисление - это процесс, при котором металлы вступают в реакцию с кислородом. При этом происходит образование оксидов металлов. Оксиды обычно являются твердыми веществами и имеют особую структуру и свойства. Например, оксид меди CuO является темно-черным порошком, который может использоваться как катализатор в химических реакциях.
Взаимодействие с кислотой - это еще один способ изменения активности металлов. Когда металл вступает в реакцию с кислотой, образуется соль и выделяется водород. Например, реакция железа Fe с соляной кислотой HCl приводит к образованию хлорида железа FeCl3 и выделению водорода H2. Это явление широко используется в промышленности, например, для получения водорода или хлорида железа.
Образование соединений - это еще один способ изменения активности металлов. Металлы могут вступать в реакцию с неметаллами и образовывать различные соединения. Например, алюминий Al может реагировать с кислородом и образовывать оксид алюминия Al2O3, который известен как красная глина. Также металлы могут образовывать соединения с другими металлами, называемые сплавами. Например, бронза - это сплав меди и олова, который обладает высокой прочностью и используется для изготовления различных предметов.
Электрические эффекты

Электрические эффекты имеют значительное влияние на активность металлов. Одним из таких эффектов является гальваническая коррозия. Она возникает при контакте двух различных металлов в присутствии электролита. В результате образуется гальванический элемент, в котором один металл выступает в роли анода, а другой - в роли катода. Под действием электролита происходит выделение электронов с анода на катод, что приводит к процессу коррозии анодного металла.
Еще одним электрическим эффектом, влияющим на активность металлов, является электрохимический потенциал. Он характеризует способность металла вступать в реакции окисления и восстановления. Металлы с более высоким электрохимическим потенциалом обладают большей активностью, так как они более легко отдают электроны и вступают в окислительно-восстановительные реакции. Например, щелочные металлы, такие как литий и калий, обладают высокой активностью из-за своего низкого электрохимического потенциала.
Другим важным электрическим фактором, влияющим на активность металлов, является растворимость ионов металла. Металлы, образующие легкорастворимые ионы, обычно проявляют большую активность. Такие металлы могут более активно участвовать в химических реакциях, так как их ионы легко перемещаются в растворе и могут взаимодействовать с другими веществами.
Электролиз, гальваническая коррозия
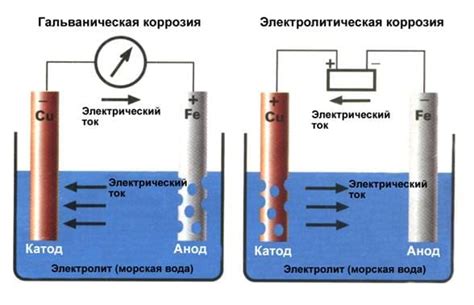
Электролиз и гальваническая коррозия являются процессами, которые влияют на активность металлов.
Электролиз - это процесс разложения вещества под действием постоянного электрического тока. В электролизе активность металлов может изменяться, так как во время этого процесса происходит перемещение ионов. В зависимости от условий, металлы могут вступать в реакцию с другими веществами или быть осаждены в виде пленки на поверхности электрода.
Гальваническая коррозия - это электрохимический процесс, при котором происходит перенос электронов между разными металлическими элементами через электролит. В результате гальванической коррозии активность металлов может изменяться, так как одни металлы становятся анодами, а другие - катодами. Аноды активно корродируют, теряя свою массу, в то время как катоды сохраняют свою активность.
Важно отметить, что активность металлов может быть также зависеть от других факторов, таких как концентрация вещества, температура и рН среды. Кроме того, состояние поверхности металла и наличие оксидной пленки также могут влиять на его активность. Поэтому для определения активности металлов в различных условиях необходимо учитывать все эти факторы.
Влияние механических факторов

Механические факторы также оказывают существенное влияние на активность металлов. Одним из таких факторов является механическое напряжение, которое может возникать в результате деформации или нагрузки на металлическую конструкцию. При наличии механического напряжения поверхность металла становится более активной, что приводит к увеличению скорости коррозии.
Кроме того, механические факторы могут вызвать поверхностную деформацию металла, как например, при обработке или изгибе. Такая деформация может привести к изменению кристаллической структуры металла и созданию дефектов, которые усиливают его активность. Следовательно, при механической обработке металла, необходимо учитывать возможное увеличение его активности и принимать соответствующие меры для предотвращения возможной коррозии.
Также, при воздействии на металл механическими факторами, возможно образование трещин и микротрещин на его поверхности, которые могут стать источником начальных точек коррозии. Следовательно, важно обеспечивать достаточную прочность металлических конструкций, чтобы предотвратить их деформацию и возникновение трещин, что поможет снизить вероятность коррозии и увеличить долговечность материала.
Вопрос-ответ

Какие факторы оказывают влияние на активность металлов?
Активность металлов зависит от нескольких факторов, включая их электрохимические свойства, степень потери или приобретения электронов, а также оксидационное состояние металла.
Что такое электрохимические свойства металлов?
Электрохимические свойства металлов отражают их способность взаимодействовать с другими веществами в электрохимических реакциях. Они определяют активность металлов в различных условиях.
Каким образом степень потери или приобретения электронов влияет на активность металлов?
Степень потери или приобретения электронов связана с реакцией металла с другими веществами. Чем легче металл отдает электроны или принимает их, тем более активен он является.
Что означает оксидационное состояние металла?
Оксидационное состояние металла характеризует количество потерянных или приобретенных им электронов при взаимодействии с другими веществами. Оно может влиять на активность металла.
Может ли температура окружающей среды влиять на активность металлов?
Да, температура окружающей среды может влиять на активность металлов. Например, повышение температуры может ускорить реакции, а низкая температура может замедлить их протекание.
