Серная кислота (H2SO4) — одна из наиболее широко используемых кислот в химической промышленности и лабораторных условиях. Она обладает сильно окислительными свойствами и активно реагирует с многими веществами, включая металлы. Реакция металлов с концентрированной серной кислотой может протекать с образованием солей и выделением водорода.
Реакция металлов с серной кислотой является классическим примером реакции, проходящей с образованием соли и выделением газа. В ходе реакции происходит окисление металлов, при котором ион металла переходит в состояние более высокой степени окисления.
Реакция сильно зависит от реакционной способности металла и концентрации серной кислоты. Некоторые металлы, такие как железо и цинк, реагируют с серной кислотой довольно медленно, образуя соответствующие соли и выделяя газ водород. Другие металлы, например, медь и свинец, взаимодействуют с серной кислотой интенсивнее и образуют более активные соединения.
Реакция с железом

Железо является одним из самых активных металлов и проявляет интенсивную реакцию с концентрированной серной кислотой.
При контакте с концентрированной серной кислотой, железо происходит окисление, а серная кислота вступает в воздействие с железом, образуя сульфат железа(II) и выделяется водород.
Реакция между железом и концентрированной серной кислотой является агрессивной и сопровождается выделением большого количества тепла и парами серной кислоты.
При этой реакции железо растворяется, образуя разнообразные реакционные продукты, включая соль железа(II), водород и воду.
Реакция между железом и концентрированной серной кислотой можно представить следующей химической формулой: Fe + H2SO4 → FeSO4 + H2 ↑.
Реакция с цинком
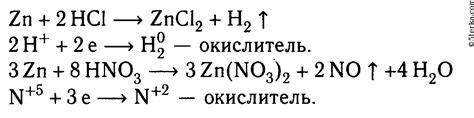
Реакция цинка с концентрированной серной кислотой – это одна из наиболее известных реакций металлов с кислотами. Цинк – активный металл, который обладает высокими окислительными свойствами. При взаимодействии с концентрированной серной кислотой происходит образование соли цинка и выделение насыщенных парами сернистого газа SO2.
Эта реакция является редокс-реакцией, то есть происходит одновременное окисление цинка и восстановление серной кислоты. Цинк окисляется из нулевого состояния (Zn0) до двухвалентного иона (Zn2+), а серная кислота восстанавливается до сернистой кислоты (H2SO3).
Реакция цинка с концентрированной серной кислотой протекает обычно с выделением сернистого газа и образованием белой кристаллической осадки соли цинка. Сернистый газ имеет резкий запах, ядовит и обладает отбеливающими свойствами, поэтому необходимо проводить реакцию в хорошо проветриваемом помещении или под вытяжкой.
Уравнение реакции между цинком и концентрированной серной кислотой выглядит следующим образом:
| Zn + H2SO4 → ZnSO4 + H2 |
Итак, реакция цинка с концентрированной серной кислотой – это редокс-реакция, при которой происходит окисление цинка и восстановление серной кислоты. В результате образуется соль цинка и выделяется сернистый газ.
Реакция с алюминием

Реакция металла алюминия с концентрированной серной кислотой является одной из наиболее известных в химической науке. Она происходит с выделением бесцветного и легко вспыхивающего газа - сернистого ангидрида.
Процесс реакции заключается в том, что молекула серной кислоты диссоциирует на ионы водорода и ионы сернокислого аниона. Молекулы водорода обладают высокой активностью и reaktioner, поэтому они мгновенно взаимодействуют с металлом алюминия, образуя воду.
Сернокислый анион реагирует с металлом, формируя сернистый ангидрид, который является газообразным и выделяется в виде пузырьков. Алюминий при этом окисляется до иона алюминия с трехвалентным зарядом.
Реакция между алюминием и серной кислотой является экзотермической, то есть сопровождается выделением тепла. Поэтому при ее проявлении наблюдается нагрев реакционной смеси. Необходимо осторожно проводить данную реакцию, так как возможен выход горячего и вспышки.
Реакция с алюминием и концентрированной серной кислотой может использоваться в лабораторных условиях для выделения газов или очистки алюминиевых поверхностей от оксида алюминия.
Реакция с медью
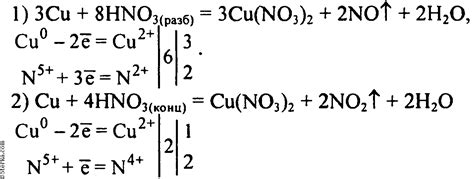
Медь – химический элемент, который относится к активным металлам. При взаимодействии с концентрированной серной кислотой происходит быстрая и интенсивная реакция, сопровождающаяся выделением большого количества тепла и образованием газа.
Реакция начинается с образования сульфата меди (II):
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
Формирующийся сульфат меди (II) обычно имеет голубой цвет и может наблюдаться в виде осадка или раствора, в зависимости от условий реакции.
Другое одним очень интересное явление, которое можно наблюдать при реакции меди с концентрированной серной кислотой, – это образование сероводорода. Сероводород является газом с характерным запахом гнилых яиц и образуется из-за взаимодействия серы, образовавшейся в реакции, с водой:
SO2 + 2H2O → H2SO3 (сернистая кислота)
H2SO3 + 2H2O → H2SO4 (серная кислота)
Таким образом, реакция меди с концентрированной серной кислотой является интенсивной и сопровождается выделением тепла, образованием сульфата меди (II) и сероводорода.
Реакция свинца с концентрированной серной кислотой

Реакция свинца с концентрированной серной кислотой является одной из наиболее характерных и важных реакций металла с кислотой. Она происходит с образованием сульфата свинца (II) и выделением сернистого газа.
Серная кислота сначала взаимодействует с поверхностью свинца, образуя защитную пленку из сульфата свинца(II). Далее, происходит дальнейшее растворение металла с образованием ионов свинца и выделением газообразного сернистого газа:
Pb + H2SO4 -> PbSO4 + H2S
Сульфат свинца(II) является малорастворимым в воде и выпадает в осадок. Это приводит к замедлению хода реакции и формированию плотного слоя осадка. Такая особенность реакции позволяет свинцу не полностью растворяться в серной кислоте, что делает его низкоактивным металлом среди остальных металлов.
Если в реакции свинца с концентрированной серной кислотой присутствует лохматый газоотводный трубопровод, в котором газ достаточно долго накапливается, то при воздействии открытого пламени на сернистый газ он может загореться с ярким синим пламенем, так как сернистый газ сам по себе может быть воспламененным.
Реакция с оловом

Олово является металлом, который относительно активен взаимодействует с концентрированной серной кислотой. Однако, эта реакция происходит в несколько более медленном темпе, чем с некоторыми другими металлами.
При взаимодействии олова с концентрированной серной кислотой, происходит выделение сернистого газа (SO₂) и образование соли олова(II)серной кислоты - SnSO₄.
Уравнение реакции выглядит следующим образом:
Sn + H₂SO₄ → SnSO₄ + SO₂ + H₂O
Реакция протекает в несколько этапов и проявляется заметное выделение бурых газов, которые состоят из сернистого газа. Также отмечается образование белого осадка соли олова(II)серной кислоты. Осадок можно выделить с помощью фильтрации.
Реакция олова с концентрированной серной кислотой, как и с другими металлами, иллюстрирует способность серной кислоты выделять сернистый газ при контакте с активными металлами. Эта реакция может использоваться в лабораторных условиях для выделения сернистого газа и получения солей металлов.
Вопрос-ответ

Что происходит при реакции металлов с концентрированной серной кислотой?
При контакте металлов с концентрированной серной кислотой происходит реакция, в результате которой образуется соответствующая соль металла и выделяется сернистый газ (диоксид серы).
Могут ли все металлы реагировать с концентрированной серной кислотой?
Нет, не все металлы реагируют с концентрированной серной кислотой. Обычно реакция происходит с активными металлами, такими как цинк, железо, алюминий, медь и др. Некоторые металлы, такие как золото и платина, вообще не реагируют с серной кислотой.
Какова схема реакции металлов с концентрированной серной кислотой?
Схема реакции металлов с концентрированной серной кислотой выглядит следующим образом: Металл + H₂SO₄ → Металл-соль + SO₂↑ + H₂O.
Какие особенности можно выделить при реакции металлов с концентрированной серной кислотой?
Основные особенности реакции металлов с концентрированной серной кислотой включают образование соответствующей металлической соли, выделение диоксида серы в виде газа и образование воды как побочного продукта реакции. Кроме того, реакция может протекать с выделением тепла, особенно если серная кислота является концентрированной.
