Реакция металла с водой - явление, в котором металл вступает в химическую реакцию с молекулами воды. Этот процесс может иметь различные особенности и приводить к различным результатам в зависимости от свойств металла и условий реакции.
Одним из самых известных и интересных примеров реакции металла с водой является реакция натрия. Когда натрий попадает в воду, происходит вспышка яркого света и выделение водорода. Это происходит из-за того, что металл активно реагирует с водой, разрушая связи между атомами воды и образуя гидроксид натрия и водород.
В отличие от натрия, некоторые металлы не реагируют с водой напрямую. Например, алюминий обладает защитной окисленной пленкой на своей поверхности, которая предотвращает прямой контакт с водой. Однако, когда окисленная пленка нарушается, алюминий начинает активно реагировать с водой и выделяться водород.
Реакция металла с водой имеет большую практическую значимость, так как может использоваться для получения водорода - важного энергетического носителя. Кроме того, изучение этого процесса помогает углубить понимание химических свойств металлов и их взаимодействия с другими веществами.
Как металл взаимодействует с водой?

Взаимодействие металлов с водой может происходить по разным сценариям, зависящим от их активности и химических свойств. Некоторые металлы реагируют с водой более интенсивно, другие - менее активно.
Например, щелочные металлы, такие как натрий и калий, очень активно реагируют с водой. При контакте с водой они выделяются из соединений в виде ионов, образуя щелочные растворы и выпуская водород. Реакция этих металлов с водой происходит достаточно быстро и может сопровождаться появлением пламени или хлопком.
Другие металлы, такие как алюминий и цинк, могут реагировать с водой, но менее интенсивно. При контакте с водой они образуют оксиды, гидроксиды и водород. Эта реакция протекает медленнее и не столь энергично, как у щелочных металлов.
Однако некоторые металлы, такие как железо и медь, обычно не реагируют с водой при комнатной температуре. Они могут требовать более высоких температур или дополнительного воздействия, чтобы начать химическую реакцию с водой.
Также стоит отметить, что взаимодействие металлов с водой может быть разным в зависимости от ее качества, наличия примесей или использования катализаторов. Кроме того, некоторые металлы могут реагировать с водой только при наличии кислорода или других реагентов.
Водородные горелки и их использование

Водородные горелки – это устройства, осуществляющие контролированное сжигание водорода. Они состоят из специального резервуара для хранения водорода, системы подачи и смешивания газа с кислородом, а также системы зажигания.
Водородные горелки активно применяются в различных областях. В промышленности они используются для обогрева и пайки металлов, а также для генерации тепла и электроэнергии. Водородные горелки также нашли применение в автомобильной отрасли. Они используются в водородных автомобилях для привода двигателей и выработки электроэнергии для электрического привода.
Преимущества использования водородных горелок включают высокую энергетическую эффективность, чистоту сжигания и низкий уровень выбросов. Водород является экологически чистым газом, и его сжигание не приводит к выбросу парниковых газов или вредных веществ.
Однако использование водородных горелок также имеет свои особенности. Водород является взрывоопасным газом, поэтому необходимы специальные меры безопасности при его использовании. Кроме того, процесс получения водорода обычно требует энергетических затрат, и его хранение может быть проблематичным из-за высокой подвижности молекул газа.
Специфика реакции щелочных металлов с водой

Щелочные металлы, такие как литий, натрий и калий, обладают своеобразной способностью реагировать с водой. При контакте с водой происходит интенсивное выделение водорода и образование щелочных гидроксидов.
Реакция начинается с образования гидроксида металла и выделения водорода. За счет высокой реакционной способности щелочных металлов и пористой структуры их поверхности процесс протекает очень быстро и сопровождается характерными всплесками и пузырьками.
Реакция щелочных металлов с водой сопровождается значительным выделением энергии в виде тепла. Поэтому важно проводить эксперименты с осторожностью, так как реакция может протекать с большой интенсивностью, усиливаясь с увеличением количества воды или металла.
Примечательно, что реактивность щелочных металлов с водой возрастает по порядку: литий реагирует самым медленным образом, а калий - самым быстрым. Это связано с различием в электрофильности металлов и их способности к образованию оксидов и гидроксидов.
Интересно, что реакция щелочных металлов с водой может быть использована в практических целях. Например, натрий используется для удаления кислорода из инертных газов, а литий – для производства легких, мощных источников энергии.
Процессы окисления и коррозии при реакции с металлами
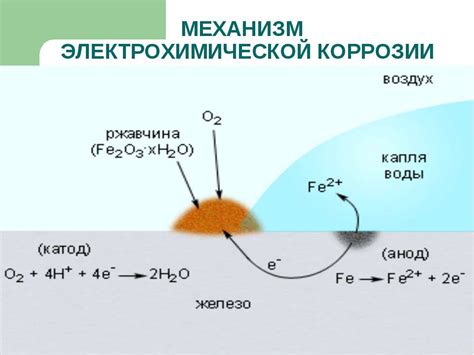
Реакция металлов с водой может вызывать процессы окисления и коррозии, которые могут иметь различные последствия и особенности.
Окисление – это процесс реакции металла с водой, при котором происходит образование оксида или гидроксида металла. В результате окисления могут появляться разнообразные покрытия на поверхности металла, такие как ржавчина или окисные пленки. Окисление может быть как полезным, так и вредным процессом в зависимости от свойств металла и условий окружающей среды.
Коррозия – это процесс разрушения металла в результате окисления под воздействием окружающей среды, особенно воды. Коррозия может привести к потере прочности и устойчивости металла, а также к образованию нежелательных отложений и загрязнений.
Одним из интересных примеров реакции с металлами является коррозия железа, которая приводит к образованию ржавчины. Реакция между железом и кислородом воздуха и водой приводит к образованию оксида железа, который имеет характерный коричневый цвет и отличается от исходного металла.
Для защиты металлов от коррозии часто применяют различные методы, такие как покрытия, гальваническая защита и использование специальных антикоррозионных препаратов. Эти методы позволяют увеличить срок службы металлов и уменьшить риск коррозии в различных условиях эксплуатации.
Опасные последствия реакции активных металлов с водой

Реакция активных металлов с водой может иметь опасные последствия, которые необходимо учитывать при работе с этими веществами. При взаимодействии с водой активные металлы, такие как натрий, калий или литий, проявляют свою химическую активность, что может привести к возникновению различных опасностей.
Во-первых, реакция активных металлов с водой может привести к образованию взрывоопасных газов, таких как водород. Водород, являясь легким и хорошо горючим газом, может создать опасность при его накоплении в закрытом помещении или при его производстве в больших объемах.
Во-вторых, реакция активных металлов с водой может вызывать высвобождение большого количества тепла. Если реакция проходит слишком интенсивно, то может возникнуть опасность перегрева и возгорания веществ, находящихся вблизи. Кроме того, высокая температура, которая может возникнуть в результате реакции, может вызвать ожоги или другие травмы.
Для предотвращения опасных последствий реакции активных металлов с водой необходимо соблюдать правила безопасности при работе с этими веществами. Рекомендуется использовать специальное оборудование и средства индивидуальной защиты, проводить реакцию в специально оборудованных помещениях, где возможно эффективное удаление образующихся газов, и следовать инструкциям производителя по безопасному хранению и использованию активных металлов.
Необычные примеры реакций металлов с водой

Вода - это один из самых популярных и доступных реагентов для металлов. Взаимодействие между металлами и водой может протекать по-разному и приводить к удивительным результатам.
Например, калий, который находится в первой группе периодической системы, реагирует с водой с огненными вспышками и выделением водорода. Эта реакция настолько интенсивная, что калий может даже загореться при контакте с водой.
Еще один интересный пример - реакция натрия с водой. При взаимодействии натрия с водой образуется щелочь - гидроксид натрия, а также выделяется водород. Во время реакции натрий движется по поверхности воды с шипением и искрами, создавая эффект яркой и зрелищной фонтан-реакции.
Алюминий, несмотря на свою стойкость к окислению, также реагирует с водой. В результате реакции алюминий образует гидроксид алюминия и выделяет водород. Эта реакция обычно протекает медленно и не так зрелищно, как реакции калия или натрия, но все же является интересным примером.
Возможно, одним из самых необычных примеров реакции металлов с водой является взаимодействие магния с паром воды. При этом образуется оксид магния и выделяется водород. Но самое интересное, что в результате реакции магний начинает гореть ярким белым пламенем. Этот эффект можно видеть, например, в химических демонстрациях или в лабораторных опытах.
Вопрос-ответ

Какие металлы реагируют с водой?
Ряд металлов способен вступать в реакцию с водой. Например, натрий (Na), калий (K), литий (Li) и цезий (Cs) реагируют с водой довольно активно, выделяя при этом водород. Алюминий (Al) также реагирует с водой, но уже более медленно и тормозится пленкой оксида, которая образуется на его поверхности.
В чем особенности реакции алюминия с водой?
Реакция алюминия с водой происходит медленнее, чем, например, реакция натрия или калия. Это связано с тем, что на поверхности алюминия образуется защитная пленка оксида, которая тормозит процесс реакции. Однако, при нагревании алюминия реакция ускоряется, так как оксидное покрытие разрушается и металл может прямо взаимодействовать с водой.
