Окисление металлов – это важное химическое явление, которое происходит при взаимодействии металла с кислородом или другими окислителями. Оно играет значительную роль в различных процессах, включая коррозию металлов, образование оксидных слоев на поверхности и электрохимические реакции.
В процессе окисления металлов происходит потеря электронов, что приводит к образованию положительно заряженных ионов металла. Окисление может происходить как спонтанно, так и под влиянием внешней силы. Часто активность окисления металлов зависит от их электрохимического потенциала, который определяется способностью металла отдавать электроны.
Механизм окисления металлов может варьироваться в зависимости от металла и условий окружающей среды. Один из наиболее распространенных механизмов – реакция, при которой металл взаимодействует с кислородом воздуха и образует оксид. Этот оксид образует защитную пленку на поверхности металла, которая предотвращает дальнейшую реакцию окисления.
Окисление металлов является неизбежным процессом, который может нанести значительный ущерб металлическим конструкциям и изделиям. Понимание основных принципов окисления металлов и механизмов, которые лежат в его основе, позволяет разработать способы защиты от коррозии и продлить срок службы металлических изделий.
Определение процесса
Процесс окисления металлов — это химическая реакция, при которой металл вступает во взаимодействие с кислородом из воздуха или другим окислителем, что приводит к образованию оксидов металлов. Окисление металлов является естественным процессом и наблюдается в повседневной жизни, например, когда железо ржавеет под действием воздуха и влаги.
Процесс окисления металлов характеризуется изменением электронного строения атомов металла и протекает по следующему механизму. Вначале на поверхности металла образуется слой оксида, который защищает металл от дальнейшего окисления. Однако со временем этот слой может быть поврежден, например, неблагоприятными условиями окружающей среды, тогда окисление металла продолжается.
Оксиды металлов, образующиеся в результате окисления, обладают различными свойствами и могут иметь как полезное, так и вредное воздействие на металл. Некоторые оксиды, например, оксид алюминия, обладают защитными свойствами и служат для формирования пассивной пленки, которая предотвращает дальнейшее окисление металла. Другие оксиды, например, оксид железа, могут привести к разрушению металла и образованию коррозии.
Понимание процесса окисления металлов имеет большое значение для различных отраслей науки и промышленности. Изучение механизмов окисления помогает разрабатывать методы защиты металлов от коррозии, создавать новые материалы с улучшенными свойствами и повышать эффективность различных процессов, связанных с использованием металлов.
Основные принципы окисления металлов

Процесс окисления металлов является важной химической реакцией, которая происходит при взаимодействии металла с кислородом воздуха или других окислителей. Основными принципами окисления металлов являются:
- Электрохимический характер процесса: окисление металла осуществляется за счет электронного переноса. Металл отдает электроны окислителю и превращается в ион положительного заряда.
- Скорость окисления зависит от активности металла: разные металлы обладают разной активностью, то есть способностью быстро окисляться. Например, активные металлы, такие как магний и натрий, окисляются очень быстро, в то время как медь или серебро окисляются намного медленнее.
- Формирование оксидной пленки: при окислении металлов на их поверхности образуется оксидная пленка, которая служит защитным слоем, предотвращающим дальнейшее окисление. Эта пленка может быть тонкой и прозрачной, как, например, оксид алюминия на алюминиевых изделиях, или плотной и видимой, как, например, ржавчина на поверхности железа.
- Влияние окружающей среды: скорость окисления металлов зависит от химического состава окружающей среды, влажности, температуры и других факторов. Некоторые окислители, например, кислотные пары или соли, могут ускорять процесс окисления, в то время как другие вещества, такие как масла или защитные покрытия, могут замедлять его.
Понимание основных принципов окисления металлов позволяет контролировать и предотвращать процесс окисления, сохраняя металлические изделия долгое время.
Взаимодействие с кислородом
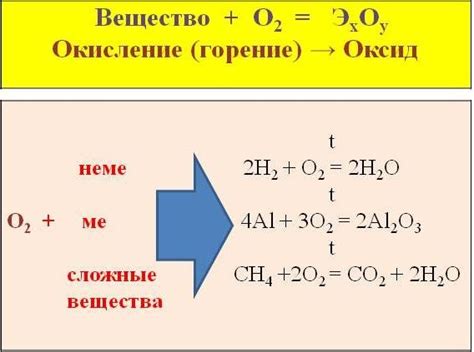
Процесс окисления металлов осуществляется путем их взаимодействия с кислородом, что приводит к образованию оксидов металлов. Окисление – сложный процесс, в результате которого атомы металла передают электроны кислороду, образуя положительно заряженные ионы металла, и электроны заполняют valence band кислорода, образуя отрицательно заряженные ионы оксигена. Для проведения реакции окисления металлы должны обладать достаточной активностью и химической реакционной способностью.
Взаимодействие металлов с кислородом может происходить как в газообразной среде, например, воздухе, так и в жидкой или твердой среде. Основными факторами, влияющими на скорость реакции окисления, являются активность металла, концентрация кислорода в окружающей среде, температура и давление. Чем выше активность металла, тем быстрее протекает процесс окисления. Концентрация кислорода также оказывает существенное влияние на скорость реакции – чем выше ее концентрация, тем быстрее протекает окисление.
Кроме того, температура и давление имеют важное значение. При повышении температуры скорость реакции окисления обычно увеличивается, так как увеличивается кинетическая энергия частиц, что способствует более активному столкновению металла с кислородом. При повышении давления скорость реакции также может увеличиваться, так как повышенное давление способствует более плотному расположению молекул кислорода, что увеличивает вероятность их столкновения с поверхностью металла.
Катодный и анодный процессы
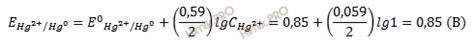
Катодный и анодный процессы представляют собой основные этапы процесса окисления металлов. Катодный процесс - это процесс снижения заряда на поверхности металла, при котором происходит улавливание электронов и их реакция с реагентами, присутствующими в растворе. Катодные процессы позволяют избежать нежелательных реакций и обеспечить эффективность окисления металла.
Анодный процесс, наоборот, представляет собой процесс окисления металла, при котором происходит выделение электронов и их перенос на анод. В результате анодных процессов происходит растворение металла и образование ионов, которые передаются в раствор и могут быть использованы для других химических реакций.
Катодный и анодный процессы являются взаимосвязанными и неотъемлемыми частями процесса окисления металлов. Они обеспечивают электронный и ионный перенос в реакции, позволяя металлу претерпеть окисление и превратиться в ионы. Такая реакция имеет большое практическое значение, так как позволяет контролировать процессы коррозии металлов и применять их в различных областях техники и промышленности.
Роль электронов и ионов

В процессе окисления металлов электроны играют ключевую роль. Они являются носителями электрического заряда и способны передвигаться по проводнику. Когда металл окисляется, электроны отдаются внешнему окружению, что приводит к образованию положительных ионов металла. Электроны, отданные металлом, переносятся в кислород или другой окислительный агент.
Ионы также играют важную роль в процессе окисления металлов. Ионы окислительного агента притягивают электроны, полученные от металла, и в результате образуют ионы с отрицательным зарядом. Это электронное перераспределение позволяет осуществить окисление металла и происходит на границе между металлом и окислительным агентом.
В процессе окисления металлов роль электронов и ионов также проявляется в разветвленной системе реакций. Металл может окисляться сразу несколькими окислительными агентами, причем одновременно или последовательно. Каждый окислительный агент принимает электроны от металла, образуя ионы этого металла с разным степенями окисления.
Ионы, образованные в результате окисления металла, не обязательно должны быть полностью развитыми окислительными агентами. Они могут быть использованы в последующих реакциях и оставаться в системе в качестве промежуточных продуктов. Такая возможность перераспределения электронов и ионов позволяет увеличить эффективность и скорость процесса окисления металла.
Механизмы окисления металлов
Механизм окисления металлов основан на реакции с молекулами кислорода из воздуха или воды. В результате этой реакции металлы постепенно превращаются в оксиды. Окисление может происходить как на поверхности металла, так и в его объеме.
Одним из основных механизмов окисления металлов является адсорбция молекул кислорода на поверхности металла. Физические и химические свойства поверхности металла определяют возможность и интенсивность адсорбции. Молекулы кислорода взаимодействуют с поверхностными атомами металла, что приводит к образованию оксидной пленки.
Еще одним механизмом окисления металлов является диссоциативная адсорбция кислорода. При этом молекулы кислорода разлагаются на две атомные группы, которые адсорбируются на поверхности металла. Далее происходит реакция между атомами кислорода и металлом, в результате которой образуется оксид металла.
Также в процессе окисления металлов можно выделить механизм электрохимического окисления. При этом металл взаимодействует с окислительным веществом, например кислородом или протонами, в присутствии электролита. В результате процесса окисления происходит электронный перенос, при котором металл постепенно окисляется.
Коррозия металлов

Коррозия металлов является распространенным и серьезным процессом, приводящим к разрушению и деградации металлических материалов. Она возникает под влиянием химических реакций с окружающей средой и может привести к значительным потерям в прочности и эксплуатационных свойствах металлов.
Основным механизмом коррозии является электрохимический процесс, при котором металл подвергается окислительно-восстановительным реакциям. Вода и воздух являются основными агентами коррозии, так как содержат кислород и влагу, необходимые для этих процессов.
Коррозия может происходить на поверхности металла или глубже в его структуре. Она проявляется в виде появления окисленных слоев или пятен на поверхности металла, а также в виде трещин, изломов и разрушений в его структуре. Это может привести к потере интегритета и прочности металлических конструкций, компонентов и изделий.
Для защиты от коррозии применяются различные методы, включая использование защитных покрытий, антикоррозионных покрытий, специальных легированных металлов и сплавов, а также применение электрохимических методов, таких как катодная защита. Кроме того, регулярное обслуживание и очистка металлических поверхностей от загрязнений и влаги также помогают предотвратить коррозию и поддерживать долговечность и надежность металлических конструкций.
В целом, коррозия металлов является непредсказуемым и неизбежным процессом, который требует постоянного внимания и ухода для минимизации его последствий. Правильное планирование, проектирование и эксплуатация металлических конструкций с учетом коррозионных процессов помогут увеличить их срок службы и эффективность.
Электрохимическое окисление
Электрохимическое окисление – это процесс, при котором металлический объект подвергается окислительной реакции в присутствии электрического тока. В результате этой реакции на поверхности металла образуется оксидное покрытие, которое может быть полезным или нежелательным в зависимости от конкретной ситуации.
Основным механизмом электрохимического окисления является процесс анодного окисления, при котором на поверхности металла происходит потеря электронов, а ионы металла перемещаются к аноду. В то же время на катоде происходит процесс катодного восстановления, при котором ионы восстанавливаются, принимая электроны и образуя нейтральные атомы металла. Таким образом, электрохимическое окисление представляет собой электродный процесс с участием анода и катода.
Электрохимическое окисление может использоваться для различных целей. Например, в процессе гальванического покрытия металлов медь или никель наносятся на поверхность других материалов, создавая защитное покрытие или улучшая эстетический вид изделия. Однако электрохимическое окисление также может приводить к нежелательным последствиям, таким как коррозия металла. Поэтому важно контролировать процесс окисления и применять соответствующие методы защиты и консервации металлических поверхностей.
Окисление через растворение

Процесс окисления металлов может происходить через растворение в водных или других растворителях с наличием соответствующих окислителей. В таких условиях металлы, подвергаясь окислительным реакциям, вступают в контакт с окислителем и выделяются ионы в раствор.
Окисление через растворение является одним из наиболее распространенных способов окисления металлов, применяемых в различных технологических процессах. Вода с примесью кислорода или других окислителей может действовать на металлы, вызывая их окисление.
В процессе окисления через растворение образуется раствор, содержащий ионы металла, при этом металлический предмет может изменять свои физические и химические свойства. Окисление металлов через растворение имеет большое практическое значение и применяется в различных отраслях, например, при производстве металлических полимерных покрытий, гальваническом покрытии, а также в химической промышленности.
Для осуществления процесса окисления через растворение необходимо контролировать условия окружающей среды, такие как концентрация окислителя, рН раствора, температура и время воздействия. Благодаря этому можно добиться нужных результатов и контролируемого окисления металла.
Вопрос-ответ

Как происходит процесс окисления металлов?
Процесс окисления металлов происходит в результате реакции между металлом и кислородом, в результате которой образуется оксид металла. Кислород осуществляет окисление металла, при этом сам восстанавливается. Реакция окисления металлов является электрохимической реакцией.
Какие принципы лежат в основе процесса окисления металлов?
Основными принципами процесса окисления металлов являются электрохимия и реакционная способность металлов. В электрохимическом аспекте, окисление металлов происходит за счет передачи электронов от металла к кислороду. Реакционная способность металлов зависит от их активности и способности образовывать соединения с кислородом.
