Окисление металлов является одним из основных процессов, которые происходят в химических реакциях. Когда металлы взаимодействуют с кислородом, происходит окисление, при котором металлы переходят из своего ионного состояния в ионное состояние. Эти реакции имеют широкое применение в различных областях науки и промышленности.
Уравнение реакции окисления металла кислородом позволяет описать этот процесс с точки зрения избыточности или нехватки кислорода, а также исходное и конечное состояние металла. Оно представляет собой химическую формулу, в которой указываются все реагенты и продукты реакции, а также их стехиометрические коэффициенты.
Например, уравнение реакции окисления железа кислородом можно представить следующим образом:
4 Fe + 3 O2 → 2 Fe2O3
В этом уравнении указано, что 4 атома железа реагируют с 3 молекулами кислорода, что приводит к образованию 2 молекул трехокиси железа. Таким образом, при окислении железа кислородом происходит образование трехокиси железа.
Процесс окисления металлов кислородом

Окисление металлов кислородом – это химическая реакция, при которой металлы реагируют с молекулами кислорода, происходящая при воздействии воздуха или кислородсодержащих веществ. Такой процесс приводит к образованию оксидов металлов.
Взаимодействие металлов с кислородом имеет самые разнообразные последствия. Одни металлы при окислительной реакции образуют оксиды, которые являются стойкими и защищают металл от дальнейшей коррозии. Например, алюминий сразу после реакции с кислородом образует плотную оксидную пленку, которая препятствует дальнейшему окислению металла.
Однако существуют и другие металлы, которые взаимодействуя с молекулами кислорода, образуют более легко разрушаемые оксиды. Эти оксиды могут растворяться в воде или кислотах, что ведет к коррозии металла. Примером может служить железо, которое, окислившись кислородом, образует ржавчину.
При окислении металлов кислородом протекают различные электрохимические процессы. Металлы, испытывающие окисление, теряют электроны и превращаются в положительно заряженные ионы. Кислород же, наоборот, принимает электроны и превращается в отрицательно заряженные ионы. Таким образом, происходит перенос электронов и образуются ионы оксида металла.
Реакции окисления металлов

Окисление металлов кислородом является одним из наиболее распространенных видов реакций, которые происходят с металлами. Под окислением понимается процесс участия металла в химической реакции с кислородом.
В результате реакции окисления металлов образуются соответствующие оксиды металлов. Например, железо при взаимодействии с кислородом образует оксид железа (III), также известный как ржавчина.
В зависимости от условий окружающей среды, окисление металлов может происходить с различной интенсивностью. Например, влажность и наличие кислорода способствуют активному окислению металлов, что приводит к их быстрому разрушению и образованию оксидной пленки на поверхности.
Реакции окисления металлов могут быть использованы в различных областях, включая производство энергии. Так, при горении металлов с кислородом выделяется значительное количество энергии. Этот процесс используется, например, в ракетостроении для получения тяги.
Таблица позволяет наглядно представить реакции окисления нескольких металлов:
| Металл | Оксид |
|---|---|
| Магний | Магниевый оксид (MgO) |
| Алюминий | Алюминиевый оксид (Al2O3) |
| Железо | Оксид железа (III) (Fe2O3) |
Использование окисления металлов находит применение не только в химической промышленности, но и в повседневной жизни. Например, образование оксидной пленки на поверхности металлических предметов может защищать их от коррозии.
Уравнение реакции окисления металлов
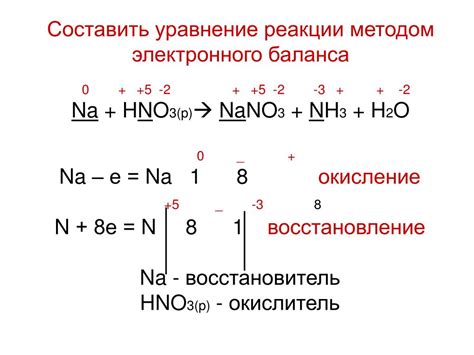
Окисление металлов кислородом является одним из наиболее распространенных и хорошо изученных процессов в химии. Окисление металлов происходит при взаимодействии металла с кислородом в присутствии влаги или воды.
Уравнение реакции окисления металлов может быть записано в следующем общем виде: металл + кислород → металлический оксид. Например, уравнение реакции окисления железа представляется следующим образом: 4Fe + 3O2 → 2Fe2O3.
В реакции окисления металла кислородом, металл теряет электроны, а кислород получает электроны. Это процесс, который называется окислением. Окисление металлов кислородом является одним из примеров внешнего окисления.
Уравнение реакции окисления металлов можно представить в расширенной форме, указав стехиометрические коэффициенты и обозначив фазы веществ: металл(s) + кислород(g) → металлический оксид(s). Например, уравнение реакции окисления цинка может быть записано следующим образом: 2Zn(s) + O2(g) → 2ZnO(s).
В зависимости от металла и условий реакции, процесс окисления металлов кислородом может протекать с разной интенсивностью и скоростью. Некоторые металлы подвергаются активному окислению и быстро образуют оксидные оболочки, что может влиять на их поведение и химические свойства. Окисление металлов кислородом имеет широкое применение в различных процессах, включая производство металлических оксидов, гальванические элементы и другие промышленные процессы.
- Формула уравнения реакции окисления металлов:
металл + кислород → металлический оксид. - Процесс окисления металла кислородом называется внешним окислением.
- Уравнение реакции окисления металлов можно записать с указанием стехиометрических коэффициентов и фаз веществ.
- Скорость окисления металла кислородом может зависеть от металла и условий реакции.
- Окисление металлов кислородом применяется в различных промышленных процессах.
Влияние окисления металлов на их свойства
Окисление металлов кислородом может существенно изменить их свойства. В процессе окисления металлы покрываются оксидной пленкой, которая может влиять на их физические, химические и механические характеристики.
Одно из основных изменений, которые происходят при окислении металлов, это изменение их цвета. Например, окисление железа приводит к образованию ржавчины, которая имеет характерный красно-коричневый оттенок. Это может быть полезным в анализе, так как по цвету окисленного металла можно судить о химическом состоянии среды или о надежности защитного слоя металла.
Кроме изменения цвета, окисление металлов может привести к образованию новых соединений, которые могут иметь другие физические и химические свойства по сравнению с исходным металлом. Например, окисление алюминия приводит к образованию оксида алюминия, который обладает высокой теплостойкостью и устойчивостью к коррозии. Это делает его подходящим материалом для применения в различных областях, таких как авиационная и космическая промышленности.
Окисление металлов также может привести к изменению их механических свойств. Например, окисление железа может привести к образованию более хрупкого оксидного слоя, что может снизить прочность и упругость металла. Это может быть проблемой, особенно в случае эксплуатации металлических конструкций в агрессивных средах, где окисление может привести к ухудшению их надежности и безопасности.
Таким образом, окисление металлов кислородом играет важную роль в определении их свойств. Изучение процессов окисления и поиск методов защиты от окисления являются актуальными задачами для различных отраслей промышленности и науки.
Применение окисления металлов

Окисление металлов находит широкое применение в различных областях науки и промышленности. Одной из основных областей использования окисления металлов является производство электроэнергии. В процессе работы аккумуляторов, металлы окисляются и выделяется электричество, которое затем может быть использовано для питания различных устройств и механизмов.
Окисление металлов также применяется в процессе производства металлических изделий. Металлы окисляются, чтобы образовать оксиды, которые затем могут быть использованы для получения различных материалов, таких как краски, керамика и стекло. Например, окисление железа используется для производства коричневых и железо-красных пигментов.
Окисление металлов также играет важную роль в области каталитических процессов. Некоторые металлы могут служить катализаторами, при которых происходят окислительные реакции. Например, платина и родий используются в автомобильных катализаторах для окисления вредных выхлопных газов, таких как оксиды азота.
Кроме того, окисление металлов может использоваться в процессе очистки воды и воздуха. Например, окисление железа и марганца может использоваться для удаления из воды различных загрязнений, включая органические и неорганические вещества. Также окисление металлов может играть роль в процессе очистки воздуха от вредных веществ.
Таким образом, применение окисления металлов охватывает широкий спектр областей, начиная от производства электроэнергии и производства материалов, до использования в каталитических процессах и очистке воды и воздуха.
Вопрос-ответ

Что такое окисление металлов кислородом?
Окисление металлов кислородом - это процесс, при котором металлы взаимодействуют с кислородом, образуя оксиды металлов. В результате этой реакции металлы теряют электроны и превращаются в положительно заряженные ионы.
Как выглядит уравнение реакции окисления металлов кислородом?
Уравнение реакции окисления металлов кислородом имеет общий вид: металл + кислород -> оксид металла. Например, уравнение реакции окисления железа кислородом выглядит следующим образом: 4Fe + 3O2 -> 2Fe2O3.
Какие свойства имеют оксиды металлов, образующиеся в результате реакции окисления кислородом?
Оксиды металлов, образующиеся в результате реакции окисления кислородом, обладают различными свойствами. Некоторые оксиды являются основаниями и образуют щелочные растворы, другие оксиды - кислотами, образуя кислотные растворы. Также в зависимости от оксида, он может быть растворимым или нерастворимым в воде, иметь разную степень окисления и т.д.
