Оксиды щелочных металлов являются одними из наиболее изученных классов химических соединений. Они образуются в результате реакции щелочной металлической кислоты с кислородом или другими оксидами. Образование оксидов щелочных металлов может происходить как в анаэробных условиях, так и при наличии кислорода.
Процесс образования оксидов щелочных металлов начинается с реакции между кислотой и металлом. Кислоты, содержащие оксиген, как правило, обладают высокой активностью и способностью давать высокую концентрацию кислорода в реакционной среде. Металлы, такие как литий, натрий, калий и др., имеют высокую реакционную способность, что позволяет им образовывать оксиды совсем при незначительной начальной концентрации кислорода в реакционной среде.
Механизм образования оксидов щелочных металлов различается в зависимости от условий реакции. В анаэробных условиях оксиды формируются путем перехода электронов от металла на кислород. В присутствии кислорода механизм реакции включает образование активированных комплексов, в которых кислород координируется с металлом и электроны передаются на активированный кислород. Следующим шагом является отщепление молекулы воды с образованием оксида щелочного металла и водорода.
Химическое свойство щелочных металлов: образование оксидов

Щелочные металлы, такие как литий, натрий, калий и другие, обладают высокой активностью и химической реакционностью. Одним из химических свойств щелочных металлов является их способность образовывать оксиды.
Оксиды щелочных металлов представляют собой химические соединения, в которых металл соединяется с кислородом. Образование этих соединений происходит путем реакции металла с кислородом воздуха или кислорода в химической реакции.
Реакция образования оксидов щелочных металлов является экзотермической и сопровождается выделением тепла. Образованные оксиды обладают особыми свойствами, такими как щелочность и способность растворяться в воде, образуя гидроксиды.
Оксиды щелочных металлов имеют широкое применение в различных отраслях промышленности и науки. Например, оксид калия используется в производстве стекла, оксиды лития применяются в литий-ионных аккумуляторах, а оксид натрия находит применение в процессе производства щелочи и мыла.
Таким образом, образование оксидов щелочных металлов является важным химическим свойством, которое находит применение в различных сферах нашей жизни.
Процесс образования оксидов щелочных металлов

Образование оксидов щелочных металлов является важным процессом в химии и имеет большое значение не только в научных исследованиях, но и в промышленности. Щелочные металлы, такие как натрий, калий и литий, образуют оксиды путем реакции с кислородом.
Наиболее распространенным способом получения оксидов щелочных металлов является прямое горение металла в кислороде. При этом происходит окисление металла и образование соответствующего оксида. Например, при горении натрия образуется оксид натрия (Na2O) по следующему уравнению:
4Na + O2 → 2Na2O
Этот процесс происходит при высокой температуре и может сопровождаться ярким свечением и выделением тепла.
В некоторых случаях оксиды щелочных металлов могут образовываться путем реакции металла с кислородом воды. Например, калий реагирует с водой, образуя оксид калия (K2O) и высвобождая водород. Уравнение этой реакции выглядит следующим образом:
2K + H2O → 2KOH + H2O
Это также процесс окисления, при котором происходит образование оксида калия.
Таким образом, образование оксидов щелочных металлов происходит путем реакции металла с кислородом. Это важный процесс, который находит свое применение в различных областях, включая производство различных химических соединений и материалов.
Взаимодействие щелочных металлов с кислородом

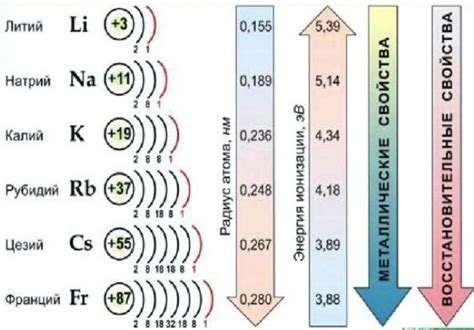
Щелочные металлы, включая литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs), обладают высокой реакционной способностью с кислородом (O2). Это связано с их низкими энергиями ионизации и высоковалентными окислительными способностями.
При контакте с кислородом щелочные металлы образуют оксиды, которые могут быть представлены как простые, так и сложные соединения. Простые оксиды, такие как оксид лития (Li2O), оксид натрия (Na2O), оксид калия (K2O), оксид рубидия (Rb2O) и оксид цезия (Cs2O), имеют структуру кристаллических солей и характеризуются высокой степенью основности.
Сложные оксиды, такие как пероксиды, супероксиды и пероксиды-супероксиды, образуются при более высоких температурах и более экстремальных условиях. Например, пероксиды щелочных металлов, такие как пероксид лития (Li2O2), пероксид натрия (Na2O2) и пероксид калия (K2O2), имеют структуру пероксидов, содержащих одну диоксидную группу (O2).
Супероксиды щелочных металлов, такие как супероксид лития (LiO2), супероксид натрия (NaO2), супероксид калия (KO2) и супероксид рубидия (RbO2), характеризуются наличием супероксидной группы (O2-). Пероксиды-супероксиды, такие как пероксид-супероксид натрия (NaO2O2) и пероксид-супероксид калия (KO2O2), представляют собой смесь пероксидной и супероксидной групп.
Окислительные свойства щелочных металлов

Щелочные металлы - это группа химических элементов, включающая лиитий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У них выражены окислительные свойства, то есть они способны отдавать электроны и окислять другие вещества в химической реакции.
В окислительных реакциях щелочные металлы образуют положительные ионы, которые привлекают отрицательно заряженные частицы других веществ. Это происходит благодаря низкой ионизационной энергии, то есть энергии, которая необходима для отрыва электрона от атома щелочного металла.
Окислительные свойства щелочных металлов проявляются во многих реакциях. Например, они могут окислять кислород и образовывать оксиды, такие как оксид лития (Li2O), оксид натрия (Na2O) или оксид калия (K2O). Эти оксиды являются алкалинными, то есть они растворяются в воде, образуя щелочные растворы.
Окислительные свойства щелочных металлов также проявляются в реакциях с другими элементами, например с водородом. При взаимодействии с водородом они могут образовывать гидриды, такие как гидрид лития (LiH), гидрид натрия (NaH) или гидрид калия (KH).
Таким образом, окислительные свойства щелочных металлов играют важную роль во многих химических реакциях и находят применение в различных областях, включая производство лекарств, промышленность и электронику.
Реакции образования оксидов щелочных металлов

Образование оксидов щелочных металлов в результате химических реакций является одним из важных процессов в химии. Оксиды щелочных металлов, таких как натрий, калий или литий, имеют множество применений в нашей жизни. Эти соединения являются не только важными компонентами в индустрии, но и используются в медицине, электронике и других отраслях.
Реакции образования оксидов щелочных металлов происходят при взаимодействии металлов с кислородом. Оксиды образуются в результате сочетания кислорода с металлом, их общая формула выглядит как М2O, где М представляет металл щелочной группы.
Одним из примеров реакции образования оксида натрия является взаимодействие металлического натрия с кислородом воздуха. В результате этой реакции образуется оксид натрия, который имеет химическую формулу Na2O. Этот оксид является основой для производства щелочей и используется в химической промышленности и стекловарении.
Реакции образования оксидов щелочных металлов могут происходить не только с кислородом, но и с другими химическими соединениями. Например, при взаимодействии лития с водой образуется оксид лития (Li2O) и молекулярный водород. Эта реакция является экзотермической и может сопровождаться выбросом горячего водорода.
Реакции образования оксидов щелочных металлов важны не только с технической точки зрения, но и с химической. Они позволяют изучить взаимодействие металлов с различными химическими соединениями и разработать новые методы их синтеза. Кроме того, реакции образования оксидов щелочных металлов имеют практическое применение в различных отраслях промышленности и науки.
Влияние условий на образование оксидов щелочных металлов
В процессе образования оксидов щелочных металлов играют важную роль различные условия, включая температуру, давление и окружающую среду. Эти факторы могут существенно влиять на химические реакции и процессы, происходящие при образовании оксидов.
Одним из ключевых условий является температура. При повышении температуры, обычно, увеличивается скорость окисления щелочных металлов и образования их оксидов. В некоторых случаях, высокая температура может способствовать образованию более стабильных оксидов, что зависит от конкретного металла.
Давление также оказывает влияние на процесс образования оксидов щелочных металлов. Высокое давление может изменять скорость химических реакций и структуру образующихся соединений. Например, повышенное давление может способствовать образованию компактных и стабильных оксидов.
Окружающая среда также играет важную роль. Некоторые оксиды щелочных металлов могут образовываться в воздухе при обычных условиях, однако другие требуют специальных условий, таких как атмосфера с ограниченным содержанием кислорода или наличие других реагентов. Например, образование оксидов может быть сопряжено с реакцией с водой или с другими соединениями.
В целом, образование оксидов щелочных металлов является сложным процессом, который зависит от множества условий. Изучение этих условий позволяет более глубоко понять механизмы и особенности образования оксидов щелочных металлов, а также может иметь практическое значение для разработки новых материалов и технологий.
Роль оксидов щелочных металлов в химических реакциях

Оксиды щелочных металлов играют важную роль в химических реакциях благодаря своим особенностям и свойствам. Они обладают высокой реакционной способностью и широким спектром применений, что делает их неотъемлемой частью многих процессов в химической промышленности и научных исследованиях.
Щелочные металлы входят в первую группу периодической системы и образуют оксиды с формулой MO, где M - металл из данной группы. Они проявляют высокую основность и могут реагировать с кислотными веществами, образуя соли и воду. Их основность обусловлена наличием свободных электронов, которые способны принять или отдать в реакциях.
Оксиды щелочных металлов широко применяются в производстве стекла, керамики и электроники. Например, оксид натрия (Na2O) используется в процессе стекловарения, где он играет роль стеклообразователя. Кроме того, оксиды щелочных металлов можно использовать в качестве катализаторов в различных реакциях.
Сульфаты, полученные из оксидов щелочных металлов, используются в сельском хозяйстве в качестве удобрений. Они обладают алкалиметрическими свойствами, способствуют нормализации кислотно-щелочного баланса почвы и повышают ее плодородие.
Таким образом, оксиды щелочных металлов являются важными компонентами в химических реакциях, которые находят применение в различных отраслях науки и промышленности. Их высокая реакционная способность и особенности свойств позволяют использовать их в различных процессах для достижения требуемых результатов.
Механизмы реакций образования оксидов щелочных металлов

Образование оксидов щелочных металлов объясняется механизмами реакций, происходящих при их взаимодействии с кислородом или оксидами других веществ. Одним из наиболее распространенных механизмов является реакция окисления металла, в результате которой образуется оксид. Для этого требуется наличие кислорода в форме газа или вещества, содержащего его.
В качестве примера механизма такой реакции можно привести взаимодействие натрия с кислородом. Натрий, образуя ион Na+, теряет один электрон, который переходит на кислородный атом, образуя ион O2-. В результате этой реакции образуется оксид натрия (Na2O).
Другим механизмом реакции образования оксидов щелочных металлов является реакция с водой. В данном случае металлический ион вступает во взаимодействие с молекулой воды, образуя оксид металла и водород. Примером такой реакции может служить реакция лития с водой, при которой образуется оксид лития (Li2O) и выделяется водородный газ.
Также оксиды щелочных металлов могут образовываться в результате реакции металла с различными кислотами. Например, при взаимодействии калия с серной кислотой образуется оксид калия (K2O) и серный газ. Этот механизм реакции основан на обмене ионами между металлом и кислотой.
Вопрос-ответ

Какие процессы и механизмы лежат в основе образования оксидов щелочных металлов?
Образование оксидов щелочных металлов происходит путем взаимодействия металлических щелочных металлов с кислородом. Этот процесс может происходить двумя способами - окислительным действием кислорода на щелочные металлы или реакцией щелочного металла с кислородом воздуха. Механизм образования оксидов зависит от условий, при которых происходит реакция, и может включать образование промежуточных соединений или проходить через стадию адсорбции кислорода на поверхности металла.
Какие соединения образуются при взаимодействии щелочных металлов с кислородом?
В результате взаимодействия щелочных металлов с кислородом образуются соединения, называемые оксидами. Для каждого щелочного металла существует свой оксид. Например, при реакции натрия с кислородом образуется оксид натрия (Na2O), при реакции калия с кислородом - оксид калия (K2O) и т.д. Оксиды щелочных металлов обладают различными физическими и химическими свойствами и широко применяются в различных отраслях промышленности.
Какие факторы могут влиять на скорость образования оксидов щелочных металлов?
Скорость образования оксидов щелочных металлов может зависеть от нескольких факторов. Во-первых, концентрация кислорода в окружающей среде может влиять на скорость реакции. Чем выше концентрация кислорода, тем быстрее будет происходить окисление щелочного металла. Во-вторых, температура также может влиять на скорость реакции. Обычно при повышении температуры скорость реакции увеличивается. Кроме того, присутствие катализаторов или промежуточных соединений также может ускорить образование оксидов щелочных металлов.
