Электролиз металлов является важным процессом в химической промышленности, который основывается на использовании электрического тока для разделения соединений металлов на элементы. Этот процесс позволяет получать чистые металлы, используемые в различных областях, включая промышленность, электронику и строительство.
Основной принцип электролиза металлов заключается в том, что при подаче электрического тока через расплавленную руду или раствор металлических солей происходит окислительно-восстановительная реакция. В результате этой реакции положительно заряженные металлические ионы притягиваются к отрицательно заряженному электроду, а отрицательно заряженные ионы притягиваются к положительно заряженному электроду.
Таким образом, электролиз позволяет разделить соединения металлов на их элементы и получить чистые металлы. В процессе электролиза металлов используются различные типы электродов, в зависимости от свойств и целей процесса. Например, для выделения металлов, таких как алюминий или медь, используют графитовые электроды, а для выделения никеля или цинка – никелевые или цинковые электроды соответственно.
Электролиз металлов является важным процессом, который позволяет получать чистые металлы с высокой степенью чистоты. Этот процесс также имеет большое значение для экологии, поскольку позволяет уменьшить вредные выбросы и использовать ресурсы более эффективно. Однако, электролиз металлов требует энергозатрат и специального оборудования, поэтому его применение осуществляется в промышленных масштабах.
Электролиз металлов: влияние тока на химические реакции
Электролиз металлов является важным процессом в химической промышленности, позволяющим получать металлы с высокой степенью чистоты. Одним из основных факторов, влияющих на процесс электролиза, является сила тока, которая оказывает решающее воздействие на химические реакции и электродные потенциалы в системе.
При электролизе металлов положительно заряженный ион металла переходит к отрицательно заряженному катоду, где получает электроны и осаждается в виде металлического элемента. Процесс отделения ионов от раствора металла и их движения к электродам определяется силой тока. Чем больше сила тока, тем больше ионы движутся к электродам, ускоряя процесс отделения и повышая скорость электролиза.
Влияние силы тока на электролиз металлов проявляется также в изменении электродных потенциалов. При увеличении силы тока, электродные потенциалы катода и анода изменяются, что может привести к изменению процессов на электродах. Силу тока следует выбирать оптимально, чтобы обеспечить эффективность процесса электролиза и предотвратить нецелевые химические реакции.
Сила тока также оказывает влияние на толщину осаждаемого металлического слоя. При увеличении силы тока, осаждение металла на электродах становится более интенсивным, что может привести к увеличению толщины слоя. Это важно учитывать при проектировании и контроле процесса электролиза для получения металла определенной толщины.
Таким образом, сила тока играет важную роль в электролизе металлов, определяя скорость электролиза, электродные потенциалы и толщину осаждаемого слоя металла. Оптимальный выбор силы тока позволяет достичь высокой эффективности процесса и получить металл с требуемыми характеристиками.
Электролиз: определение и принцип действия
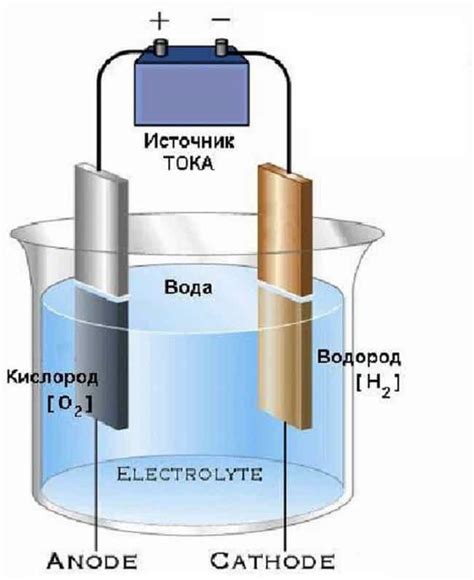
Электролиз - это процесс, при котором разлагаются вещества под действием электрического тока. Электролиз в основном используется для получения различных металлов из их соединений, таких как соли или оксиды.
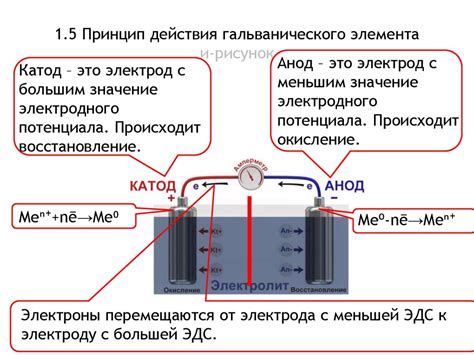
Принцип действия электролиза основан на применении электролита, который является электролитической ячейкой. В ячейке находятся два электрода: анод и катод, подключенные к источнику постоянного электрического тока. Анод - это положительно заряженный электрод, на котором происходит окисление, т.е. отдача электронов в электролит. Катод - это отрицательно заряженный электрод, на котором происходит восстановление, т.е. получение электронов из электролита.
При подаче электрического тока в электролит электроны двигаются от анода к катоду через электролит. В результате окисления на аноде происходит образование положительных ионов, которые перемещаются через электролит к катоду, где происходит их восстановление с образованием металлического элемента или соединения.
Применение электролиза позволяет получать металлы высокой чистоты, которые часто используются в промышленности, таких как алюминий, медь, никель и др. За счет возможности контроля электрического тока, скорости реакции и других параметров, электролиз является эффективным методом получения металлов и широко используется в химической и металлургической промышленности.
Электролиты и их роль в электролизе

Электролиты играют ключевую роль в процессе электролиза. Электролиты - это вещества, способные проводить электрический ток в растворе или расплаве. Во время электролиза электролит разлагается под воздействием тока на положительно и отрицательно заряженные ионы, которые перемещаются к электродам.
Роль электролита в электролизе заключается в том, что он обеспечивает передачу электрического тока через раствор или расплав. Он создает проводящую среду для перемещения ионов к аноду и катоду.
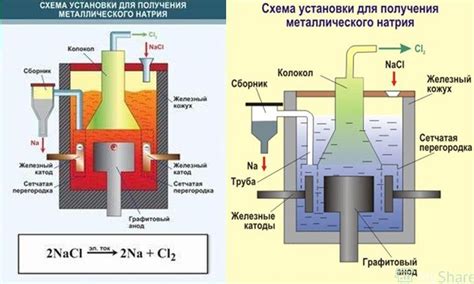
Электролиты в электролизе металлов могут быть как солями, так и кислотами. Например, для получения металла алюминия используется электролит, состоящий из топливного масла и смеси солей (фторида алюминия и хлорида кальция). При электролизе электрический ток под действием электродов приводит к разложению электролита и выделению металла на катоде.
Выбор электролита для электролиза зависит от свойств реагентов и требуемого результата. Важно подобрать электролит, который будет эффективно разлагаться и иметь достаточную проводимость для передачи тока. Электролиты также могут добавляться для регулирования скорости электролиза или улучшения качества получаемого продукта.
Таким образом, электролиты играют важную роль в электролизе, обеспечивая проводимость и разложение ионов под действием тока. Выбор электролита зависит от конкретной задачи и требуемых характеристик получаемого продукта.
Анод и катод: их функции и реакции
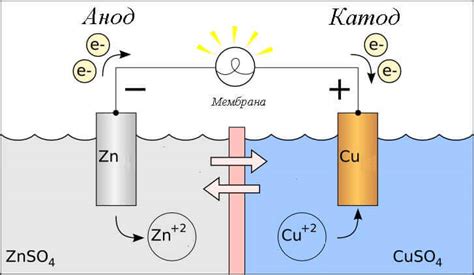
Анод – это электрод, на котором происходит окислительная реакция во время электролиза. Он является положительно заряженным и притягивает отрицательно заряженные ионы, называемые анионами. Анионы, попадая на анод, отдают свои электроны и претерпевают окислительные реакции. Например, в процессе электролиза раствора солей металла на аноде происходит окисление анионов, атмосферного кислорода или самого металла.
Катод – это электрод, на котором происходит восстановительная реакция во время электролиза. Он является отрицательно заряженным и притягивает положительно заряженные ионы, называемые катионами. Катионы, попадая на катод, получают электроны и претерпевают восстановительные реакции. Например, в процессе электролиза раствора солей металла на катоде происходит восстановление катионов, снижение кислорода или осаждение самого металла.
Общая реакция в электролизе состоит из отдельных реакций, происходящих на аноде и катоде. На аноде образуются ионы, которые перемещаются через электролит к катоду. На катоде ионы получают электроны и происходит их восстановление или осаждение в виде металла. Этапы электролиза зависят от свойств и химической природы вещества, подвергаемого электролизу.
Влияние тока на процессы в электролизе
Электролиз металлов – это процесс, при котором переходят в состояние ионов. Возникающие при этом химические реакции зависят от тока, который проходит через электролит.
Ток в электролизе определяет направление движения ионов. Если в среде преобладают положительные ионы, изначально они будут перемещаться в направлении к отрицательной электроде. Аналогично, отрицательные ионы будут двигаться к положительной электроде. Электроды, с которыми связано движение ионов, называются анодом и катодом.
Ток в электролизе также оказывает влияние на скорость протекания химической реакции и процесс осаждения металла на электроде. Чем больше ток, тем быстрее протекает процесс электролиза и быстрее металл осаждается на электроде. Отрицательные электроды, на которых происходит осаждение металла, называются катодами.
При электролизе металлов необходимо поддерживать постоянную силу тока, чтобы контролировать скорость ионной миграции и процесс осаждения металла. Если сила тока слишком мала, металл будет осаждаться очень медленно или вовсе не будет осаждаться на электроде. Слишком большая сила тока может привести к неконтролируемому осаждению металла, что может повлиять на качество и равномерность покрытия металлом.
Практическое применение электролиза в производстве металлов
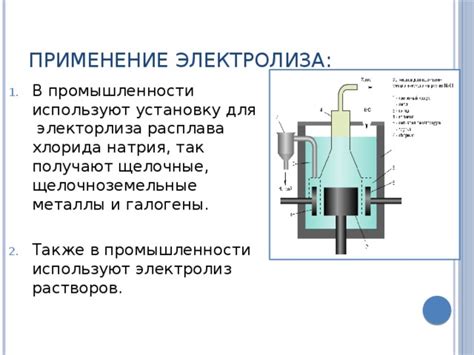
Электролиз - это процесс, при котором электрический ток используется для разложения вещества на составные части. Этот метод находит широкое применение в производстве различных металлов.
Один из наиболее практически значимых примеров - получение алюминия. Алюминий является одним из наиболее распространенных металлов в мире и используется во множестве отраслей. Электролиз применяется для разложения алюминиевых руд и получения чистого металла. Этот процесс требует большого количества энергии, но результатом является высококачественный алюминий, который широко используется в авиации, строительстве, электронике и других отраслях.
Еще одним примером применения электролиза является получение меди. Медь является одним из самых важных металлов в мире и используется в электротехнике, строительстве, медицине и других отраслях. Электролиз используется для извлечения меди из ее руд, таких как медные сульфиды. Этот процесс позволяет получать высококачественную медь с высокой степенью чистоты, что делает ее идеальным материалом для проводников и других приложений.
Кроме того, электролиз применяется в производстве цинка, никеля, свинца и других металлов. Он также может быть использован для получения покрытий и пластин на металлических изделиях, что улучшает их износостойкость и эстетический вид. Электролиз - это эффективный, точный и контролируемый метод производства металлов, который позволяет получать высококачественные продукты с оптимальными свойствами для различных отраслей промышленности.
Преимущества и ограничения электролиза

Электролиз – это процесс, при котором электрический ток используется для превращения химических веществ. Такой способ имеет ряд преимуществ и ограничений.
Преимущества электролиза:
- Эффективность: электролиз позволяет получить чистые вещества с высокой степенью очистки.
- Выборочность: электролиз позволяет выборочно отделять и получать отдельные элементы из смесей.
- Масштабируемость: электролиз может применяться как в лабораторных условиях, так и в промышленности для массового производства.
- Экологичность: электролиз может быть экологически чистым методом производства, особенно если используется возобновляемая энергия.
Однако электролиз также имеет свои ограничения:
- Энергозатратность: электролиз требует больших энергетических затрат из-за необходимости подачи электрического тока.
- Стоимость: из-за энергозатратности электролиз может быть дорогостоящим методом производства.
- Ограниченность веществ: не все вещества можно электролизировать, так как некоторые могут разлагаться или искажать процесс.
- Требуется специальный оборудование: для проведения электролиза требуется специальное оборудование, что может повысить сложность и стоимость процесса.
В целом, электролиз является важным и эффективным методом для получения чистых веществ и разделения смесей, но его использование может быть ограничено из-за высоких энергетических затрат и некоторых ограничений веществ.
Вопрос-ответ

Как происходит электролиз металлов?
Электролиз металлов происходит путем воздействия электрического тока на электролит, содержащий металлические ионы. Под воздействием тока происходит окисление ионов на катоде и восстановление ионов на аноде, что приводит к осаждению металла на катоде.
Какие процессы происходят в электролизе металлов?
В электролизе металлов происходят несколько процессов. На катоде происходит редукция, то есть восстановление металлических ионов, которые осаждаются на поверхности катода. На аноде происходит окисление, то есть ионы металла переходят в состояние ионов и уходят в электролит.
Как зависит скорость электролиза металлов от силы тока?
Скорость электролиза металлов пропорциональна силе тока. Чем больше ток, тем быстрее происходит осаждение металла на катоде и выделение ионов на аноде. Однако при слишком большой силе тока могут происходить побочные реакции или возникнуть проблемы с нагревом электролита.
Какие факторы влияют на эффективность электролиза металлов?
На эффективность электролиза металлов влияют несколько факторов. Во-первых, сила тока - чем больше ток, тем быстрее происходят химические процессы. Во-вторых, концентрация металлических ионов в электролите - чем выше концентрация, тем больше металла будет осаждаться на катоде. В-третьих, температура - обычно при повышении температуры скорость реакций увеличивается. Наконец, электроды - правильно подобранные электроды с повышенной проводимостью могут улучшить эффективность электролиза.
Какую роль играют катод и анод в электролизе металлов?
Катод и анод играют важную роль в электролизе металлов. На катоде происходит осаждение металла, восстановление металлических ионов. На аноде происходит окисление, и ионы металла переходят в состояние ионов и уходят в электролит. Катод и анод должны быть изготовлены из материалов, способных проводить электрический ток и стойких к действию электролита и образующихся реагентов.
