Оксиды металлов – это соединения, в состав которых входят один или несколько металлов в окисленном состоянии. Кислоты, в свою очередь, являются химическими соединениями, способными отдавать протоны. Взаимодействие оксидов металлов с кислотами приводит к образованию солей и воды.
Одним из признаков такого взаимодействия является образование характерных осадков или газовых пузырьков. Например, при взаимодействии оксида натрия с соляной кислотой образуется осадок хлорида натрия, который можно наблюдать в виде белых кристаллов. Также может образовываться газ, который проявляется в виде пузырьков, например, при взаимодействии оксида цинка с уксусной кислотой.
Другим признаком взаимодействия оксидов металлов с кислотами является изменение цвета или внешнего вида реакционной смеси. Например, при взаимодействии оксида железа с серной кислотой реакционная смесь становится черной. Это связано с образованием серной кислоты и железного сульфида, который имеет черный цвет.
Также можно заметить повышение температуры реакционной смеси при взаимодействии оксидов металлов с кислотами. Это связано с выделением энергии в результате химической реакции. Например, при взаимодействии оксида меди с соляной кислотой наблюдается повышение температуры реакционной смеси и выделение тепла.
Физические свойства

Оксиды металлов – это химические соединения, обладающие определенными физическими свойствами. Они обычно представляют собой твердые вещества при комнатной температуре и обладают высокой теплостойкостью.
Однако, физические свойства оксидов металлов могут существенно различаться в зависимости от конкретного соединения. Некоторые оксиды могут быть нерастворимыми в воде, в то время как другие легко растворяются в кислотах или щелочах.
Температура плавления оксидов металлов также может существенно варьироваться. Если некоторые оксиды плавятся при низких температурах, то другие требуют очень высоких температур для плавления.
Интересной особенностью некоторых оксидов металлов является их способность образовывать кристаллическую решетку. Это может влиять на их механические свойства, такие как твердость и прочность.
Кроме того, некоторые оксиды металлов обладают электрической проводимостью, что делает их полезными в различных электронных устройствах.
Оксиды металлов
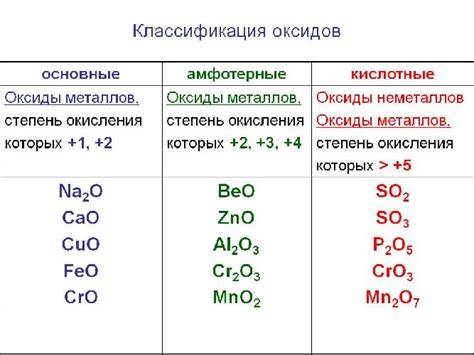
Оксиды металлов – это химические соединения, состоящие из металлического элемента и кислорода. Оксиды металлов широко распространены в природе, они образуют значительную часть земной коры. Некоторые оксиды металлов имеют ценные свойства и находят широкое применение в различных отраслях промышленности.
Оксиды металлов могут быть как щелочными, так и кислыми. Щелочные оксиды образуются при соединении металла с кислородом, а кислые оксиды образуются при соединении полу-металла с кислородом. Разные оксиды металлов обладают различными физическими и химическими свойствами, что определяет их возможные применения.
Оксиды металлов являются основными компонентами ряда кислот, таких как сульфатная, хлорная, фосфорная и др. В реакции с кислотами оксиды металлов образуют соли и воду. Таким образом, они могут выступать в качестве оснований и играть важную роль в нейтрализации кислотных растворов.
Особенности взаимодействия оксидов металлов с кислотами зависят от различных факторов, таких как концентрация кислоты и оксида металла, температура реакции и т. д. В реакции может образоваться сильно кислотная или щелочная среда, что может повлиять на направление реакции и образование конечного продукта.
Таким образом, оксиды металлов играют важную роль в химических реакциях и имеют разнообразные применения. Они являются основными компонентами солей и выполняют функцию основания при взаимодействии с кислотами. Изучение взаимодействия оксидов металлов с кислотами позволяет лучше понять химические свойства и применение данных соединений в различных сферах.
Кислоты
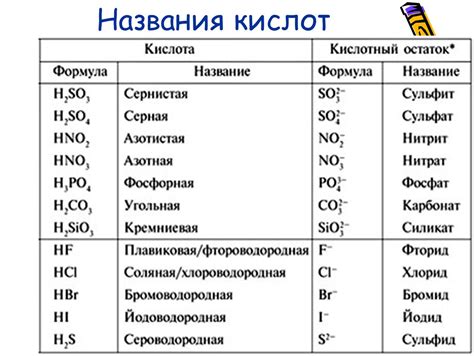
Кислоты – это химические соединения, которые способны отдавать протоны (H+) в растворе. Они могут быть органическими или неорганическими. Органические кислоты содержат один или несколько карбоксильных групп (-COOH), а неорганические кислоты обычно содержат кислород и водород.
Кислоты обладают рядом характерных свойств. Они имеют кислый вкус и способны реагировать с металлами, основаниями и оксидами металлов. Многие кислоты имеют коррозионное действие на различные поверхности, что делает их опасными в использовании.
Взаимодействие оксидов металлов с кислотами является одним из важных процессов в химии. При этом образуются соли и вода. Эта реакция может проходить с выделением тепла или поглощением тепла. Некоторые оксиды металлов реагируют с кислотами очень активно, например, оксиды щелочных металлов (натрия, калия) или кальция.
Известным примером взаимодействия оксида металла с кислотой является реакция оксида железа Fe2O3 с сульфатной кислотой H2SO4. В результате образуется Fe2(SO4)3 и вода H2O. Эта реакция позволяет получать железные соли, которые имеют широкое применение в промышленности и сельском хозяйстве.
Химические свойства

Оксиды металлов проявляют различные химические свойства при контакте с кислотами. Взаимодействие зависит от степени окисления металла и кислотности раствора.
Сильные оксиды, такие как оксиды щелочных металлов (например, оксид натрия), проявляются как щелочные свойства при растворении в воде. Они гидратируются, образуя гидроксиды, которые формируют основу.
Слабые оксиды, такие как оксиды непереходных металлов (например, оксид алюминия), обычно не проявляют щелочные свойства в водных растворах. Они реагируют с кислотами, образуя соли с соответствующими кислотами.
Реакция между оксидами металлов и кислотами может быть кислотно-основной или реакцией окисления-восстановления. В кислотно-основных реакциях оксиды металлов вступают в реакцию с кислотами, образуя соли и воду. В реакциях окисления-восстановления оксиды металлов могут быть окислены или восстановлены в процессе реакции.
Реакция оксидов металлов с кислотами
Оксиды металлов являются ключевыми соединениями при взаимодействии с кислотами. В такой реакции оксид металла работает в качестве основания, а кислота — в качестве кислоты Бренстеда. Итак, растворение оксидов металлов в кислотах приводит к образованию солей и воды.
Регулярное употребление оксидов металлов в промышленности и повседневной жизни определяется их свойствами. Это соединения металлов с кислотами — сильными электролитами, в которых металл является основателем. В результате реакции оксид металла с кислотой наблюдается образование солей и воды.
Некоторые металлы способны растворяться в кислотах с выделением газа. Это связано с высокой активностью металла и его способностью образовывать соль и водород. Например, реакция кальция с соляной кислотой приводит к образованию соли хлорида кальция и выделению водорода.
Известна также реакция оксидов металлов, при которой происходит образование оксоанйонов. Оксиды металлов взаимодействуют с кислотой, образуя соли, воду и оксоанйоны. Например, при взаимодействии оксида алюминия и соляной кислоты образуется алюмохлорид и оксоанйон водорода.
Таким образом, реакция оксидов металлов с кислотами играет важную роль в многих отраслях науки и промышленности. Понимание основных закономерностей и свойств этих реакций позволяет эффективно использовать оксиды металлов в различных областях, от химической промышленности до медицины.
Вопрос-ответ

Какие признаки указывают на взаимодействие оксидов металлов с кислотами?
Признаки взаимодействия оксидов металлов с кислотами включают образование солей, выделение газов, образование воды, изменение цвета растворов и т.д.
Какие соли образуются при взаимодействии оксидов металлов с кислотами?
При взаимодействии оксидов металлов с кислотами образуются соли, которые состоят из металлической частицы и аниона кислоты. Например, при взаимодействии оксида меди с соляной кислотой образуется соль меди (II) хлорида (CuCl2).
Какие газы могут выделяться при взаимодействии оксидов металлов с кислотами?
При взаимодействии оксидов металлов с кислотами могут выделяться различные газы: кислород, углекислый газ, диоксид серы, аммиак и т.д. Например, при взаимодействии оксида цинка с серной кислотой образуется диоксид серы (SO2) и вода (H2O).
