Щелочные металлы – это группа элементов, которая состоит из лития (Li), натрия (Na), калия (K), рубидия (Rb), цезия (Cs) и франция (Fr). Они имеют маленькие радиусы и низкую электроотрицательность, что делает их идеальными конструкционными компонентами во многих химических соединениях. Их природное взаимодействие с другими элементами обладает особым химическим воздействием, создавая уникальные свойства и структуры соединений.
Взаимодействие щелочных металлов с различными элементами приводит к образованию разных химических соединений, таких как соли, оксиды, гидриды и многое другое. Благодаря своей низкой электроотрицательности щелочные металлы способны обменяться электронами с другими элементами, что приводит к стабилизации соединений. Они могут образовывать как ионные, так и ковалентные связи, в зависимости от химической природы реагента.
Щелочные металлы играют важную роль в различных областях науки и техники, таких как энергетика, медицина и материаловедение. Их способность образовывать стабильные химические соединения позволяет использовать их в разработке новых материалов, катализаторов и электродов. Понимание природы и основных принципов взаимодействия щелочных металлов с другими элементами является важной задачей в современной химии и может открыть новые возможности для создания инновационных решений и технологий.
Щелочные металлы и их взаимодействие
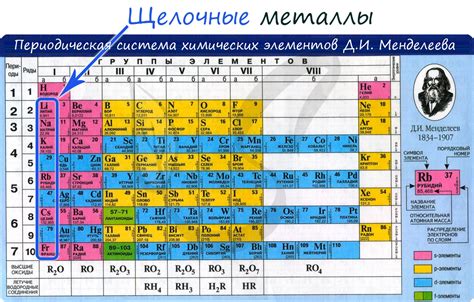
Щелочные металлы – это химические элементы первой группы периодической таблицы, которые включают в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они отличаются высокой химической активностью и способностью легко образовывать соединения с другими элементами.
Взаимодействие щелочных металлов и других элементов может привести к возникновению различных химических соединений. Эти соединения могут иметь различную структуру и свойства, в зависимости от характеристик щелочного металла и взаимодействующего элемента.
Одним из основных свойств щелочных металлов является их способность образовывать ионы с положительным зарядом. Эти ионы являются основой для образования соединений с различными отрицательно заряженными ионами. Например, кальций (Ca) и фтор (F) могут образовывать соединение CaF2, а натрий (Na) и хлор (Cl) – NaCl.
Взаимодействие щелочных металлов также может происходить с другими неметаллическими элементами, например, с кислородом (O). Образовавшиеся соединения, такие как оксиды, обладают различными свойствами и широко используются в различных отраслях промышленности.
Важно отметить, что взаимодействие щелочных металлов может быть сильно эндотермическим, то есть требовать постоянного поступления энергии для его осуществления. Это объясняется высоким уровнем активности щелочных металлов и их стремлением к образованию жестких химических связей с другими элементами.
Свойства щелочных металлов

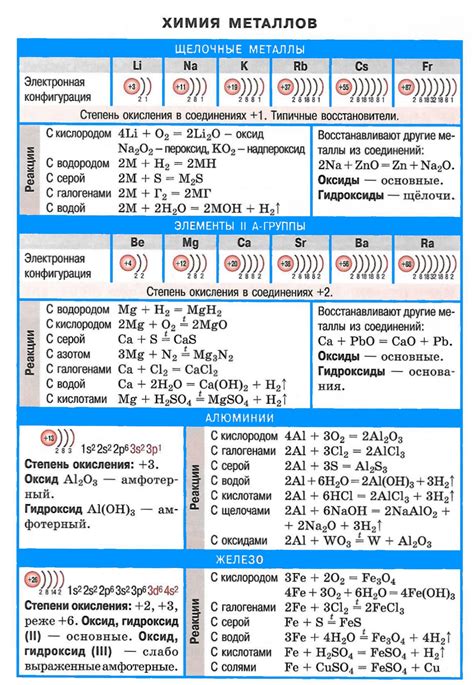
Щелочные металлы - это группа элементов периодической системы, включающая литий, натрий, калий, рубидий, цезий и франций. У них есть несколько общих свойств, которые определяют их химическую активность и использование в различных областях.
1. Активность: Щелочные металлы являются очень активными химическими элементами и легко вступают в реакцию с кислородом, водой и другими веществами. Они образуют ионы со зарядом +1 и обладают высоким окислительным потенциалом.
2. Мягкость: Щелочные металлы имеют мягкую текстуру и могут легко резаться ножом. Это связано с их низкой твердостью и невысокой плотностью. К примеру, литий имеет плотность всего лишь примерно в два раза больше плотности воды.
3. Низкая плотность: Благодаря своей низкой плотности, щелочные металлы плавают на воде и могут быть использованы для создания легких конструкций. Они также проявляют низкую плотность паров, что делает их хорошими материалами для легких летательных аппаратов.
4. Цветовые свойства: Щелочные металлы имеют ярко-металлический оттенок, который можно наблюдать при их нагревании или вступлении в реакцию с водой или кислородом. Например, калий при сжигании излучает ярко-фиолетовое пламя.
5. Участие в реакциях: Щелочные металлы хорошо вступают в реакцию с водой, образуя гидроксиды и выделяя водород. Это свойство используется в батареях и различных процессах электролиза. Они также образуют соли с различными кислотами, обладающими различными цветами и свойствами.
Окисление и восстановление
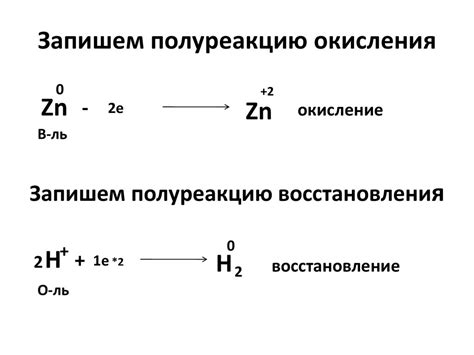
Окисление и восстановление являются важными процессами в химии, которые происходят в среде взаимодействия щелочных металлов с другими элементами или соединениями. Окисление - это процесс, при котором атом или ион теряет электроны, а восстановление - процесс, при котором атом или ион получает электроны.
Взаимодействие щелочных металлов с кислородом является хорошим примером окисления и восстановления. Например, щелочные металлы, такие как натрий и калий, способны легко окисляться в присутствии кислорода. При этом они теряют электроны и образуют ионы металла, которые имеют положительный заряд. Это окисление.
Наоборот, окисленные ионы щелочных металлов могут восстанавливаться с помощью реакции с веществами, обладающими способностью отдавать электроны. Например, восстановление катионов натрия может происходить при взаимодействии с алюминием, который обладает способностью восстанавливаться до нулевой степени окисления, отдавая электроны катиону натрия. В этом случае натрий принимает электроны и образует нейтральный атом. Это восстановление.
Окисление и восстановление важны не только в химии, но и во многих других областях, таких как электрохимия, биохимия и энергетика. Процессы окисления и восстановления играют ключевую роль в реакциях, связанных с передачей электронов, и определяют свойства множества веществ и соединений, включая многие химические элементы и их соединения.
Реакции щелочных металлов с кислотами
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают высокой активностью и образуют гармоничные химические соединения при взаимодействии с кислотами.
Вода является одной из наиболее распространенных кислот, и реакция щелочных металлов с ней происходит с выделением водорода. Глубина взаимодействия зависит от активности металла, причем литий наиболее реактивен. Например, литий плавится в воде и образует щелочной раствор с преобладанием гидроксида лития.
Кроме воды, щелочные металлы способны реагировать с различными кислотами, такими как соляная кислота, серная кислота и даже уксусная кислота. При этом образуются соли и выделяются соответствующие газы. Например, реакция натрия с соляной кислотой приводит к образованию хлорида натрия и выделению хлороводорода.
Важно отметить, что реакции щелочных металлов с кислотами происходят с выделением энергии в виде тепла и света. Это свидетельствует о химической гармонии между металлами и кислотами, которая позволяет им образовывать устойчивые и сбалансированные соединения.
Реакции щелочных металлов с водой

Взаимодействие щелочных металлов с водой является одним из наиболее известных и важных процессов в химии. Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают высокой реакционной способностью и реагируют с водой, образуя гидроксиды и выделяя водород. Эти реакции происходят как в простых условиях, так и при повышенных температурах и давлениях.
В результате реакции щелочных металлов с водой образуется гидроксид соответствующего металла и выделяется водород. Реакция является экзотермической, то есть сопровождается выделением тепла. К примеру, реакция натрия с водой протекает по следующему уравнению:
2Na + 2H2O → 2NaOH + H2
Реакция происходит с высвобождением большого количества тепла и выделением газообразного водорода. Именно поэтому при проведении реакции важно соблюдать осторожность и проводить ее в специальных условиях.
Реакции щелочных металлов с водой имеют практическое значение и находят применение в различных областях, включая производство водорода, гидроэнергетику и производство энергии из возобновляемых источников. Кроме того, эти реакции используются в химическом анализе для определения содержания щелочных металлов в различных образцах.
Образование соединений щелочных металлов

Соединения щелочных металлов обладают особенностями, которые определяются их электронной конфигурацией и химическими свойствами. Щелочные металлы имеют одну валентную электрон в своей внешней энергетической оболочке, что делает их очень активными при образовании соединений с другими элементами.
Образование соединений щелочных металлов является результатом реакций с элементами, образующими тугоплавкие соли, кислород, азот и галогены. В таких реакциях щелочные металлы отдают свой электрон и образуют ионы положительного заряда, которые образуют ионные соединения с отрицательно заряженными анионами.
Примером таких соединений являются галогениды щелочных металлов, например хлорид натрия (NaCl). Данные соединения обладают кристаллической структурой, в которой металлы и анионы образуют регулярную сетку.
Соединения щелочных металлов также могут образовывать соли с кислородом и азотом. Например, нитрат натрия (NaNO3). Такие соединения могут быть ионными или ковалентными, в зависимости от электроотрицательности анионов и катионов. Часто ионы щелочных металлов образуют сложные ионные соединения, в которых они образуют комплексные ионы, сопровождаемые координирующими анионами.
Значение и приложения щелочных металлов

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, имеют огромное значение в различных областях науки и техники.
Литий широко применяется в производстве аккумуляторов, особенно для мобильных устройств, так как обладает высокой энергоемкостью и длительным сроком службы. Кроме того, литий используется в фармацевтической и стекольной промышленности.
Натрий является важным компонентом пищевых продуктов и используется в производстве различных солей, мыла и моющих средств. Благодаря своим светооптическим свойствам, натрий также применяется в производстве электрических ламп и стекла.
Калий используется в сельском хозяйстве для удобрений, так как является неотъемлемым элементом для роста растений. Он также используется в производстве стекла, мыла и производстве бумаги.
Рубидий и цезий применяются в научных исследованиях, в технических приборах и волоконно-оптической связи. Они также используются в разработке ядерных реакторов и вакуумных трубок.
Щелочные металлы играют важную роль в разных отраслях науки и промышленности, обеспечивая надежность, энергосбережение и технологический прогресс.
Вопрос-ответ

Зачем изучать взаимодействие щелочных металлов?
Изучение взаимодействия щелочных металлов позволяет понять особенности этих элементов и их химических свойств. Это знание важно для разработки новых материалов, применения в различных отраслях промышленности и медицине, а также для понимания процессов, происходящих в природе.
Какие соединения образуют щелочные металлы?
Щелочные металлы образуют соединения с различными элементами, такими как кислород, сера, азот, хлор и другие. Например, они могут образовывать оксиды, сульфиды, нитриды, галогениды и т.д. Каждое из этих соединений имеет свои уникальные свойства и применения.
Какие свойства характерны для соединений щелочных металлов?
Соединения щелочных металлов обладают некоторыми общими свойствами. Они часто обладают высокой растворимостью в воде, образуя щелочные растворы. Они также могут быть хорошими проводниками электричества и тепла. За счет своей химической активности, соединения щелочных металлов широко используются в различных реакциях и процессах.
