Оксиды – это химические соединения, состоящие из кислорода и другого химического элемента. Их важность в химии и технологии трудно переоценить, поскольку они играют ключевую роль во многих процессах. Часто металлы реагируют с оксидами, образуя новые соединения с противоположными свойствами.
Примеры реакций оксидов с металлами могут быть разнообразными и зависят от химических свойств оксида и металла. Реакция между металлом и оксидом может привести к образованию нового оксида металла или металлического элемента. Такие реакции могут быть использованы в различных областях, включая промышленность и научные исследования.
Например, реакция между кальцием и оксидом кальция:
Ca + CaO -> CaO2
В этой реакции кальций (Ca) и оксид кальция (CaO) вступают в химическую реакцию, результатом которой является образование диоксида кальция (CaO2). Данный процесс может быть использован для получения диоксида кальция, который широко применяется в промышленности.
Другим примером может быть реакция между железом и оксидом железа:
Fe + Fe2O3 -> 3FeO
В данной реакции железо (Fe) и оксид железа (Fe2O3) реагируют, образуя трехатомный оксид железа (FeO). Такая реакция может использоваться для получения оксида железа, который может быть использован как катализатор или компонент в различных процессах.
Примеры химических уравнений реакций оксидов с металлами демонстрируют разнообразие реакций, которые могут произойти между этими соединениями. Понимание этих реакций играет важную роль в различных отраслях науки и технологии и может быть использовано для разработки новых продуктов и процессов.
Реакция металлов с кислородом

Реакция металлов с кислородом – это химическая превращение, при которой металл вступает в реакцию с кислородом, образуя оксиды металлов. Кислород является одним из наиболее распространенных и активных элементов, и его взаимодействие с металлами очень важно как в природе, так и в промышленности.
Реакция металлов с кислородом происходит путем окисления металла. Кислород становится окислителем, а металл – восстановителем. Процесс сопровождается выделением энергии в виде тепла и света.
В результате реакции металлов с кислородом образуются оксиды металлов. Оксиды могут быть различных типов, в зависимости от вида металла и условий реакции. Например, некоторые металлы образуют основные оксиды, которые растворяются в воде и образуют щелочные растворы. Другие металлы образуют амфотерные оксиды, которые могут реагировать как с кислотами, так и с щелочами. Еще другие металлы образуют кислотные оксиды, которые растворяются в воде и образуют кислотные растворы.
Реакция металлов с кислородом имеет практическое значение в технологических процессах, таких как производство металлов и сплавов, производство кислорода, производство кислот и многих других. Кроме того, эта реакция играет важную роль в природных процессах, таких как коррозия металлов и окисление минералов.
Уравнения реакций с щелочными металлами

Щелочные металлы в периодической системе химических элементов включают в себя литий, натрий, калий, рубидий и цезий. У данных металлов химические свойства, связанные с их взаимодействием с оксидами, находят широкое применение в различных отраслях промышленности и научных исследованиях.
Реакции щелочных металлов с оксидами можно описать с помощью химических уравнений. Например, реакция лития с кислородом (оксидом) может быть записана следующим образом:
2Li + O2 → 2Li2O
В данном уравнении цифра перед соединением означает коэффициент стехиометрии, то есть отношение молей реагентов к их количеству в реакции. В данном случае, две молекулы лития реагируют с одной молекулой кислорода и образуют две молекулы оксида лития.
Эта реакция показывает, что щелочные металлы, взаимодействуя с оксидами, образуют соединения, которые называются щелочными оксидами. В результате таких реакций происходит эндотермическое сжигание металла с образованием соответствующего оксида.
Однако, реакции щелочных металлов с оксидами могут иметь и другие варианты. Например, реакция натрия с кислородом может привести к образованию супероксида натрия:
2Na + O2 → 2NaO2
Таким образом, уравнения реакций щелочных металлов с оксидами зависят от конкретного металла, его окислительности и условий проведения реакции.
Реакция оксидов металлов с кислотами
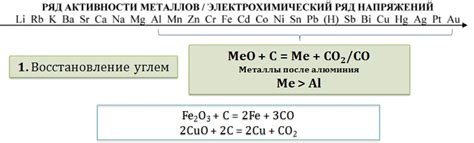
Реакции оксидов металлов с кислотами являются классическими примерами образования солей и воды. Оксиды металлов представляют собой химические соединения, в которых металл существует в более высокой степени окисления, а кислоты являются соединениями, способными выделять положительные ионы водорода (протоны).
Реакция металлического оксида с кислотой протекает следующим образом: оксид взаимодействует с кислотой, образуя соль и воду. В ходе этой реакции протоны из кислоты переходят на металл, а кислород из оксида соединяется с водородом из кислоты. Таким образом, оба компонента - оксид и кислота - теряют свои характеристики и превращаются в новые вещества - соль и вода.
Реакции оксидов металлов с кислотами можно представить в виде химических уравнений. Например, реакция оксида кальция (CaO) с соляной кислотой (HCl) приводит к образованию соли - хлорида кальция (CaCl2) и воды (H2O). Уравнение реакции может быть записано следующим образом: CaO + 2HCl → CaCl2 + H2O.
Другим примером реакции оксида металла с кислотой является реакция оксида алюминия (Al2O3) с серной кислотой (H2SO4). В результате данной реакции образуется соль - сульфат алюминия (Al2(SO4)3) и вода (H2O). Уравнение реакции можно записать следующим образом: Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O.
Уравнения реакций с щелочными металлами

Щелочные металлы, такие как натрий, калий и литий, являются высоко реакционными элементами, которые активно взаимодействуют с оксидами. Реакции этих металлов с оксидами часто приводят к образованию оснований.
Одним из примеров реакции щелочных металлов с оксидами является реакция натрия с кислородом. Уравнение реакции имеет вид: 2Na + O2 -> 2Na2O. В результате этой реакции образуется оксид натрия.
Еще одна хорошо известная реакция – взаимодействие калия с кислородом. Уравнение реакции выглядит следующим образом: 4K + O2 -> 2K2O. В результате этой реакции образуется оксид калия, который представляет собой щелочную соль.
Наконец, реакция лития с кислородом приводит к образованию оксида лития. Уравнение реакции имеет вид: 4Li + O2 -> 2Li2O. Оксид лития является щелочным оксидом, который может использоваться в различных промышленных процессах.
Таким образом, реакции щелочных металлов с оксидами приводят к образованию оснований. Эти реакции широко применяются в различных областях, включая промышленность и науку.
Реакция металлов с перекисью водорода

Перекись водорода (Н2О2) - это химическое соединение, состоящее из молекул, содержащих два атома водорода и два атома кислорода. Перекись водорода является сильным окислителем и может реагировать с различными веществами, в том числе с металлами.
Реакция металлов с перекисью водорода может протекать с образованием воды и металлического оксида. Например, реакция меди (Cu) с перекисью водорода может быть представлена уравнением:
- 2Cu + H2O2 → CuO + H2O
При этом медь окисляется, а перекись водорода восстанавливается до воды. В результате образуется медный оксид и вода.
Также можно наблюдать реакцию алюминия (Al) с перекисью водорода:
- 2Al + 3H2O2 → Al2O3 + 3H2O
В данном случае алюминий окисляется, а перекись водорода восстанавливается до воды. В результате образуется оксид алюминия и вода.
Реакция металлов с перекисью водорода происходит по принципу окислительно-восстановительных реакций, где перекись водорода выступает в роли окислителя. В результате реакции металлы окисляются, а перекись водорода восстанавливается до воды.
Уравнения реакций с железом, медью и серебром
Оксиды представляют собой химические соединения, состоящие из атомов кислорода, связанных с атомами других химических элементов. Когда оксиды вступают в реакцию с металлами, происходят химические превращения, которые можно описать уравнениями реакций.
Рассмотрим примеры уравнений реакций оксидов с железом, медью и серебром:
Реакция оксида железа(III) и железа:
2 Fe2O3 + 3 Fe → 4 Fe3O4
В данной реакции оксид железа(III) взаимодействует с железом, образуя оксид железа(II).
Реакция оксида меди(I) и меди:
2 Cu2O + Cu → 6 CuO
В данной реакции оксид меди(I) реагирует с медью, образуя оксид меди(II).
Реакция оксида серебра и серебра:
2 Ag2O + 4 Ag → 6 Ag2O
В данной реакции оксид серебра взаимодействует с серебром, образуя оксид серебра.
Эти реакции являются примерами химических превращений, которые происходят при взаимодействии оксидов с металлами. Изучение таких реакций помогает понять свойства и взаимодействия различных химических соединений и элементов.
Реакция металлов с другими оксидами
Оксиды металлов представляют собой химические соединения, образованные металлами и кислородом. Они могут вступать в реакции с другими оксидами, образуя новые соединения.
Примером такой реакции является реакция оксида меди (II) с оксидом алюминия. При нагревании этих двух соединений образуется новое вещество - алюминат меди.
Еще одним примером реакции металлов с оксидами является реакция оксида железа (III) с оксидом кальция. При нагревании этих соединений образуется новое вещество - феррат кальция.
Интересной реакцией металлов с другими оксидами является реакция оксида цинка с оксидом меди (II). В результате этой реакции образуются два новых вещества - оксид цинка и медь.
Реакция металлов с другими оксидами может происходить при разных условиях. Например, некоторые реакции могут происходить при обычной комнатной температуре, а другие требуют нагревания. Также влияние на реакцию могут оказывать концентрация реагентов и наличие катализаторов.
Вопрос-ответ

Какие могут быть примеры химических уравнений реакций оксидов с металлами?
Примеры химических уравнений реакций оксидов с металлами включают, например, реакцию металла меди (Cu) с оксидом железа (FeO), которая приводит к образованию меди (Cu) и оксида железа (Fe2O3):
Каково значение этих реакций?
Примеры химических уравнений реакций оксидов с металлами являются примерами реакций окисления и восстановления. В этих реакциях оксид металла теряет кислород (окисляется), а металл получает кислород (восстанавливается).
Какие еще примеры химических уравнений реакций оксидов с металлами вы можете привести?
Еще один пример - реакция оксида цинка (ZnO) с алюминием (Al), которая приводит к образованию алюминиевого оксида (Al2O3) и металла цинка (Zn):
