Химические реакции металлов и неметаллов представляют собой фундаментальные процессы, определяющие свойства и применение данных элементов. Различные химические реакции металлов и неметаллов могут проявляться во множестве форм, включая окисление, взаимодействие с кислородом, образование солей и многое другое.
Некоторые металлы, такие как железо и алюминий, обладают свойством окисляться при взаимодействии с кислородом воздуха. Это явление известно как коррозия. В результате химической реакции с кислородом, поверхность металла покрывается оксидной пленкой, что может привести к дальнейшей коррозии или защитить металл от возможных повреждений.
Неметаллы, в свою очередь, также проявляют ряд интересных химических реакций. Например, реакция с кислородом углерода воздуха приводит к образованию углекислого газа, являющегося одним из основных компонентов атмосферы. Также неметаллы могут взаимодействовать сетью водородных связей между атомами, что способствует образованию сложных молекул органических веществ.
Металлы: основные свойства и применение

Металлы - это химические элементы, обладающие определенными свойствами. Они обладают высокой теплопроводностью, электропроводностью, пластичностью и твердостью. Эти свойства делают металлы полезными в различных областях человеческой деятельности.
Теплопроводность: Металлы отличаются от других материалов своей высокой теплопроводностью. Это позволяет использовать их в производстве теплообменных элементов, таких как радиаторы, термоэлектрические устройства и тепловые трубки.
Электропроводность: Металлы являются отличными проводниками электричества. Из-за своей высокой электропроводности они широко используются в производстве электронных компонентов, электрических проводов и соединений.
Пластичность: Металлы обладают способностью к изменению формы без разрушения. Их пластичность делает возможным использование металлов для изготовления различных деталей и конструкций, включая автомобили, самолеты, здания и многие другие.
Твердость: Некоторые металлы обладают высокой твердостью и стойкостью к износу. Это делает их идеальными для использования в инструментах, прочных деталях машин и оружии.
Металлы находят множество применений в различных отраслях промышленности. Они используются в производстве автомобилей, самолетов, кораблей, строительных материалов, электроники, мебели, упаковки и многих других товаров. В медицине металлы применяются для изготовления имплантатов и медицинского оборудования. Пожалуй, ни одна отрасль промышленности не обходится без применения металлов благодаря их уникальным свойствам и прочности.
Реакции металлов с кислородом: образование оксидов

Металлы являются активными элементами, которые способны взаимодействовать с кислородом и образовывать оксиды. Реакции металлов с кислородом имеют важное практическое значение и широко применяются в различных отраслях промышленности.
При контакте активных металлов, таких как натрий, калий, с кислородом происходит интенсивное окисление. В результате реакции образуются соответствующие оксиды металлов. Например, с натрием получается оксид натрия (Na2O), а с калием - оксид калия (K2O).
Оксиды металлов, полученные в результате реакции с кислородом, обладают различными свойствами и широко применяются в разных областях. Например, оксид алюминия (Al2O3) имеет высокую теплостойкость и применяется в производстве огнеупорных материалов. Оксид железа (Fe2O3) используется в производстве стали и металлургии. Оксид кальция (CaO), или известь, используется в строительстве и сельском хозяйстве.
Реакции металлов с кислородом протекают с распределением энергии, что сопровождается выделением тепла и света. Такие реакции часто сопровождаются жаром и искрами. Некоторые реакции металлов с кислородом являются самовоспламеняемыми, например, реакция алюминия с кислородом.
Реакции металлов с кислородом могут протекать только при наличии активного кислорода. Если металл находится в обычных условиях, то он не взаимодействует с кислородом и не образует оксиды. Например, серебро, золото и платина не образуют оксиды и не взаимодействуют с кислородом в обычных условиях.
Взаимодействие металлов с кислотами: образование солей и выделение водорода

Металлы взаимодействуют с кислотами, образуя соли и выделяя водород. Это реакция окисления металлов кислородом из кислоты и образование кислотных солей. В ходе этой реакции происходит передача электронов от металла к кислороду, что приводит к окислению металла и восстановлению кислорода.
Процесс взаимодействия металла с кислотой можно представить следующим образом. Кислота отдает протон (водородный ион) металлу, образуя ион ангидридной формулы. В результате металл окисляется, а кислота превращается в его кислотную соль.
Примерами таких реакций являются взаимодействие цинка (Zn) с соляной кислотой (HCl), образующее соль хлорида цинка и выделяющееся водород:
- Zn + 2HCl → ZnCl2 + H2
Аналогично, мы можем рассмотреть реакцию магния (Mg) с серной кислотой (H2SO4), результатом которой является образование сульфата магния и выделение водорода:
- 2Mg + H2SO4 → 2MgSO4 + H2
Такие реакции имеют важное применение в различных отраслях промышленности и в повседневной жизни. Например, процесс получения водорода путем реакции металлов с кислотами широко используется в химической промышленности, напрмер, для производства аммиака и других химических веществ. Кроме того, взаимодействие металлов с кислотами является одним из методов анализа металлов и кислот в лабораторных условиях.
Реакции металлов с водой: образование оснований и выделение водорода

Металлы могут образовывать реакции с водой, при которых происходит выделение водорода и образование оснований. Такие реакции носят название реакций металлов с водой.
Многие металлы, такие как натрий, калий и литий, активно реагируют с водой, особенно при ее нагревании или когда к ней добавляют кислотные катионы. В результате реакции металлов с водой образуется соответствующее основание и выделяется водородный газ.
Например, реакция натрия с водой можно представить следующим образом: 2Na + 2H2O → 2NaOH + H2. В результате этой реакции образуется гидроксид натрия (NaOH) и выделяется водород (H2).
Реакции металлов с водой имеют практическое применение. Например, водород, выделяющийся при реакции, широко используется в различных отраслях промышленности, таких как химическая и нефтегазовая. Основания, образующиеся при реакции, также имеют применение в химической промышленности, например, в производстве мыла и моющих средств. Кроме того, реакции металлов с водой являются одним из методов получения водорода для использования в различных технологиях и энергетических системах.
Реакции металлов с солями: обмен металлов и получение нетоксичных соединений
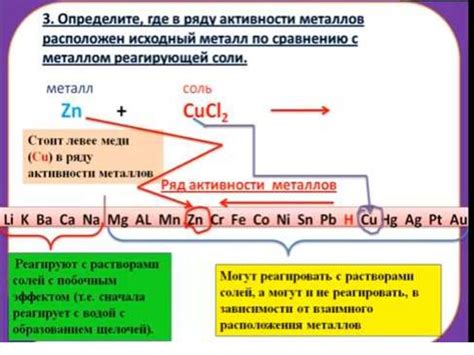
Реакции металлов с солями представляют собой один из видов окислительно-восстановительных реакций, в которых происходит обмен металлов. Металлы имеют способность вступать в реакцию с солями других металлов, что приводит к образованию новых соединений.
Обмен металлов осуществляется за счет разности активности металлов. Металл с более высокой активностью выталкивает из соли металл с более низкой активностью. Например, реакция меди с раствором железного(II) сульфата приводит к образованию соляной кислоты и меди(II) сульфата:
FeSO4 + Cu --> CuSO4 + Fe
Такие реакции широко используются в промышленности для получения нетоксичных соединений. Например, реакция цинка с растворами свинца и кадмия приводит к образованию соответствующих солей цинка и осаждению соответствующего металла:
| Реакция | Стартовые вещества | Конечные вещества |
|---|---|---|
| Zn + Pb(NO3)2 | Цинк, нитрат свинца | Цинк, осадок свинца |
| Zn + CdCl2 | Цинк, хлорид кадмия | Цинк, осадок кадмия |
Такие реакции позволяют получать нетоксичные соединения металлов и одновременно очищать сточные воды от тяжелых металлов, что является важным применением этих реакций в экологических технологиях.
Неметаллы: основные свойства и применение

Неметаллы - это элементы, обладающие высокой электроотрицательностью и неспособные электронами передавать ток. Они являются основными строительными блоками органических соединений и играют важную роль в химических реакциях и процессах.
Основные свойства неметаллов:
- Неметаллы обладают низкой теплопроводностью и электропроводностью. Это связано с их способностью принимать электроны, а не отдавать их.
- Они обычно хрупкие и не обладают металлическим блеском.
- В большинстве случаев неметаллы образуют ковалентные соединения, в которых атомы связаны общими парами электронов.
- Они могут существовать в трех физических состояниях: газообразном, жидком и твердом.
Применение неметаллов:
- Кислород - основной неметалл, входящий в состав воздуха. Он используется в медицине, при производстве стекла, вдыхаемых смесей, а также в процессах окисления и горения.
- Углерод - важный неметалл, который является основным компонентом органических соединений и жизни на Земле. Он используется в производстве стали, полимерных материалов, топлива, электродов и других продуктов.
- Азот - неметалл, необходимый для жизни растений и животных. Он используется в производстве удобрений, взрывчатых веществ и смесей для консервации пищевых продуктов.
- Фосфор - важный неметалл, применяемый в производстве удобрений, огнетушителей, фосфорных соединений и фертильных грунтах для земледелия.
- Хлор - неметалл, широко используемый в процессе дезинфекции питьевой воды, производстве хлорированного пластика, средств для бассейнов и многих других областях промышленности.
Таким образом, неметаллы играют важную роль в разных сферах нашей жизни и широко применяются в различных процессах и производствах благодаря своим уникальным свойствам и химическим реакциям.
Вопрос-ответ

Какие свойства металлов приводят к их вовлечению в химические реакции?
Металлы обладают рядом свойств, которые предопределяют их способность к участию в химических реакциях. Одно из главных свойств металлов - высокая электропроводность. Это связано с наличием свободных электронов у атомов металла, которые легко перемещаются внутри металлической решетки. Благодаря этому металлы обладают способностью к образованию ионов положительного заряда и протеканию электрического тока. Кроме того, металлы обычно обладают блеском, высокой пластичностью и теплопроводностью. Все эти свойства делают металлы активными участниками химических реакций.
Какие примеры химических реакций с участием металлов можно привести?
С участием металлов можно привести множество примеров химических реакций. Например, реакция металла с кислородом, называемая окислением металла. При этой реакции металл окисляется, т.е. отдаёт свои электроны, а кислород восстанавливается, т.е. принимает электроны. Примером такой реакции может служить сгорание металла на воздухе, например, горение металлической магнезии. Ещё одной характерной реакцией металлов является их растворение в кислотах. Например, разложение цинка в соляной кислоте с образованием иона цинка и выделением водорода. Это лишь некоторые из примеров реакций металлов, но их много и они всегда связаны с передачей электронов и изменением окислительно-восстановительного состояния металла.
