Щелочные металлы в химии известны своей высокой реактивностью и широким спектром соединений. Натрий, калий, рубидий, цезий и франций обладают сходными химическими свойствами, что делает их незаменимыми при работе в лаборатории и промышленности. В данной статье мы рассмотрим несколько примеров соединений с щелочными металлами, начиная с их реакций и заканчивая применением в различных областях науки и техники.
Одним из наиболее распространенных соединений с щелочными металлами являются гидроксиды.
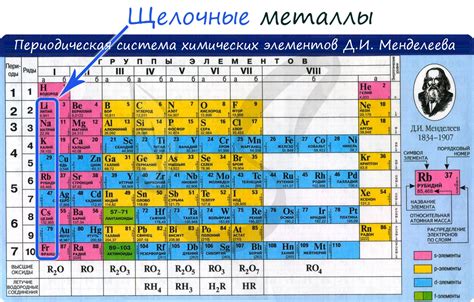
Гидроксиды щелочных металлов

Гидроксиды щелочных металлов получаются в результате реакции металлов с водой. Их основные свойства - высокая щелочность и способность растворяться в воде. Гидроксиды щелочных металлов широко используются в различных отраслях: в медицине для получения лекарственных препаратов и антисептиков, в производстве глазированной посуды, стекла и керамики, а также в качестве щелочных электролитов в алкалиновых аккумуляторах.
Соли щелочных металлов
Щелочные металлы образуют соли с такими антикислотными элементами, как хлор, бром, йод, кислород, сера, фтор, фосфор и др. Эти соединения характеризуются высокой стабильностью и широким спектром применений. Например, хлориды натрия, калия, рубидия, цезия и франция используются в производстве пищевых добавок, пищевой соли, консервантов, а также в получении лекарственных средств и средств для очистки воды.
Щелочные металлы в электронике
В электронике щелочные металлы находят широкое применение в виде алкалиновых элементов (батарей). Натрий, калий и другие щелочные металлы являются важными компонентами аккумуляторов благодаря своей способности выделять электроэнергию при реакции с электролитами. Благодаря этому такие батарейки имеют высокую энергетическую плотность и могут использоваться в различных устройствах, от микрофонов до космической техники.
Использование щелочных металлов и их соединений в различных областях науки и промышленности является важным фактором прогресса и развития технологий. Реактивные свойства и широкие возможности применения делают щелочные металлы ценным инструментом для исследования и реализации новых идей.
Описание реакций щелочных металлов

Щелочные металлы, такие как литий, натрий, калий и другие, хорошо известны своей реакционной способностью. Они являются самыми реакционноспособными металлами в периодической системе. Рассмотрим некоторые из наиболее характерных реакций щелочных металлов.
Вода является одним из наиболее распространенных реагентов, с которыми щелочные металлы реагируют. При взаимодействии с водой они образуют гидроксиды и выделяются водород. Например, литий реагирует с водой, образуя гидроксид лития (LiOH) и выделяя водород (H2). Натрий также образует гидроксид натрия (NaOH) и выделяет водород.
Другой реакционный реагент, с которым щелочные металлы реагируют, - это кислород. Взаимодействие щелочных металлов с кислородом приводит к образованию оксидов металлов. Например, литий при горении на воздухе образует оксид лития (Li2O), который обладает щелочными свойствами.
Интересно, что щелочные металлы также могут реагировать с инертными газами, такими как азот и аргон. При этом образуются металлические нитриды и азиды. Например, натрий реагирует с азотом, образуя нитрид натрия (Na3N), который может использоваться в качестве источника азота в химических реакциях.
Щелочные металлы также обладают способностью реагировать с кислотами, образуя соединения сольного типа. Например, реакция натрия с хлористоводородной кислотой приводит к образованию хлорида натрия (NaCl), который является наиболее распространенной солью щелочных металлов.
Реакция натрия с водой

Реакция натрия с водой является химической реакцией, при которой натрий реагирует с водой, образуя гидроксид натрия и выделяя водород. Эта реакция происходит взрывоопасно и считается одной из наиболее известных реакций между металлом и водой.
Реакция начинается с того, что натрий вступает в контакт с водой. При этом происходит эндотермическое освобождение энергии, что приводит к интенсивному испарению воды и образованию плавящейся соли. Затем натрий начинает реагировать с оставшейся водой, образуя гидроксид натрия и выделяя водород.
Реакция натрия с водой может быть представлена следующим уравнением:
2Na + 2H2O → 2NaOH + H2
Гидроксид натрия, который образуется в результате этой реакции, является щелочным раствором и имеет ряд применений. Он широко используется в промышленности для изготовления мыла, бумаги, стекла и других продуктов. В медицине гидроксид натрия используется в качестве антацида для уменьшения кислотности желудочного сока.
Реакция натрия с водой имеет значительное практическое применение в химии и промышленности из-за способности натрия образовывать гидроксид натрия, который широко используется в различных процессах и продуктах.
Реакция калия с водой

Реакция калия с водой является одной из наиболее зрелищных реакций, которая протекает с выделением большого количества тепла и образованием щелочного раствора.
При контакте кусочка калия с водой происходит быстрое растворение металла. В результате этой реакции образуются щелочной раствор гидроксида калия и высвобождается водородный газ. Сама реакция сопровождается вспышкой и хлопком.
Реакция калия с водой характеризуется высокой активностью металла и способностью образовывать гидроксиды щелочных металлов. Калий принадлежит к группе щелочных металлов, которые реагируют с водой в соответствии с общей формулой:
- 2 M + 2 H2O → 2 M(OH) + H2
Данная реакция является экзотермической, то есть сопровождается выделением тепла. Она может быть использована в промышленности для получения гидроксида калия (каустика) или при проведении опытов в химической лаборатории для демонстрации реакций гидроксидов щелочных металлов с водой.
Примеры соединений щелочных металлов
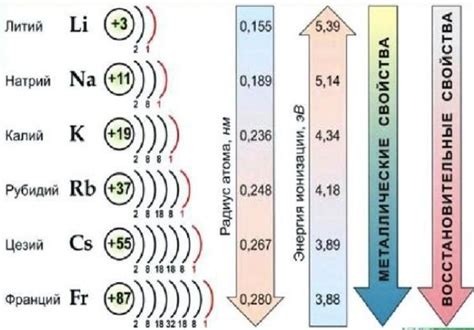
Щелочные металлы, такие как литий, натрий, калий и рубидий, обладают особыми свойствами, что делает их полезными в различных областях. Они активно реагируют с водой, кислородом и другими элементами, образуя разнообразные соединения.
Литий (Li), ионный радиус которого является наименьшим среди щелочных металлов, образует различные химические соединения. Например, литиевая соль уксусной кислоты (CH3COOLi) используется в батареях и электролитах. Кроме того, литиевая соль, в сочетании с алюминием, используется для создания термоядерного реактора.
Натрий (Na) образует соединения с различными элементами. Натриевая соль (NaCl) широко используется в пищевой промышленности и в качестве пищевой добавки. Кроме того, натрий образует соединения с кислородом, образуя оксид натрия (Na2O), который может быть использован в производстве стекла и губчатой керамики.
Калий (K) также образует различные соединения, включая калиевые соли, широко применяемые в сельском хозяйстве как удобрения. Калий обладает способностью реагировать с водой, образуя гидроксид калия (KOH), который используется в производстве мыла и удобрений.
Рубидий (Rb) образует ряд соединений, включая рубидиевый перманганат (RbMnO4), который может быть использован в лаборатории в качестве окислителя. Рубидий обладает также высоким потенциалом для использования в электрохимических батареях и радиоизотопных источниках электроэнергии.
Соляризация натрия

Соляризация натрия является одним из способов применения щелочного металла в различных областях науки и промышленности.
Соляризация - это процесс, при котором натрий, обрабатываемый высокой температурой и ультрафиолетовым излучением, преобразуется в пригодную для использования форму - солярий.
Солярий натрия является бесцветным или слабо желтоватым твердым веществом, которое обладает уникальными свойствами. Он является сильным окислителем и используется в различных процессах окрашивания и красительной промышленности.
Кроме того, солярий натрия используется в производстве стекла и керамики, а также для улучшения свойств бетона. Он также находит применение в фотографии, где используется в качестве активатора в процессе развития фотоследа.
Таким образом, соляризация натрия является важным процессом, который позволяет использовать этот щелочной металл в различных отраслях промышленности и науки.
Получение гидроксида калия

Гидроксид калия (каустическая щелочь) – важный щелочной реагент, широко используемый в различных отраслях промышленности и научных исследованиях. Этот химический соединение получают различными способами.
Один из основных способов получения гидроксида калия - это электролиз раствора хлорида калия. В данном процессе используются специальные электролизеры, в которых происходит разложение воды на гидроксид калия и хлор. При этом гидроксид калия осаждается на отрицательном полюсе электролизера.
Еще одним способом получения гидроксида калия является реакция металлического калия с водой. При взаимодействии калия с водой происходит экзотермическая реакция, при которой образуется гидроксид калия и высвобождается водород. Данная реакция сопровождается характерными яркими пламенем и шипением.
Гидроксид калия имеет широкий спектр применения. Он используется в производстве мыла, бумаги, стекла, удобрений, химической промышленности и в других отраслях. Также гидроксид калия находит применение как щелочь в химических лабораториях и в качестве сильного щелочного реагента при растворении трудно растворимых веществ.
Вопрос-ответ

Какие соединения могут образовываться щелочными металлами?
Щелочные металлы, такие как литий, натрий и калий, могут образовывать широкий спектр соединений. Они могут образовывать соединения с кислородом, серой, азотом, галогенами и другими элементами. Например, литий образует соединения с кислородом в виде оксидов, с серой в виде сульфидов и с азотом в виде нитридов.
Какие реакции могут происходить при взаимодействии щелочных металлов с водой?
Щелочные металлы могут реагировать с водой, образуя гидроксиды и выделяя водород. Например, натрий реагирует с водой, образуя гидроксид натрия (щелочь) и выделяя водородный газ. Реакция выглядит следующим образом: Na + H2O → NaOH + H2.
Какие примеры применения соединений щелочных металлов?
Соединения щелочных металлов имеют широкое применение в различных областях. Например, гидроксиды щелочных металлов, такие как гидроксид натрия (щелочь), используются в химической промышленности для очистки и обезжиривания поверхностей. Карбонаты щелочных металлов, такие как карбонат натрия, используются в стекольной, бумажной и мыльной промышленности. Щелочные металлы также применяются в батареях, лампах, стекле и других областях.
Какова роль щелочных металлов в живых организмах?
Щелочные металлы, такие как натрий и калий, играют важную роль в живых организмах. Натрий, например, необходим для поддержания правильной равновесия воды в организме и функционирования нервной системы. Калий также важен для нормального функционирования нервной системы и мышц. Щелочные металлы могут также взаимодействовать с другими элементами, образуя комплексы, которые играют роль в метаболических процессах организма.
