Щелочные оксиды – это химические соединения, в которых кислород связан с атомами щелочных металлов. Они являются одними из наиболее распространенных оксидов в природе и широко применяются в различных областях науки и техники. Вода и соли металлов – основные представители щелочных оксидов, которые играют важную роль во многих химических и биологических процессах.
Вода, или оксид водорода (H2O), является наиболее известным щелочным оксидом. Она состоит из двух атомов водорода и одного атома кислорода, которые связаны между собой ковалентной связью. Вода является универсальным растворителем и обладает рядом уникальных свойств, таких как высокая теплоемкость, плотность, поверхностное натяжение и т.д. Она играет важную роль во всех биологических системах и необходима для жизнедеятельности всех организмов.
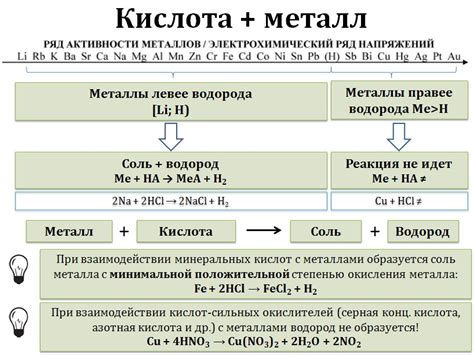
Соли металлов – вещества, образующиеся при реакции металлов с кислотами. Они представляют собой ионообменные кристаллы, в которых положительно заряженные ионы металла связаны с отрицательно заряженными ионами кислоты. Соли металлов широко используются в различных отраслях промышленности, таких как производство стекла, керамики, лекарств, пищевых продуктов и т.д. Они играют важную роль во многих химических реакциях и обладают разнообразными физическими и химическими свойствами.
Вода и соли металлов
Вода и соли металлов являются важными компонентами химических реакций и процессов. Вода, или H2O, является основным растворителем в природе и необходима для поддержания жизни на Земле.
Когда металлический элемент реагирует с водой, происходит образование основного оксида металла и выделение водорода. Например, натрий реагирует с водой, образуя гидроксид натрия (NaOH) и выделяя водородный газ (H2). Это явление известно как гидролиз.
Соли металлов, такие как хлорид натрия (NaCl) или сульфат меди (CuSO4), образуются при реакции металла с кислотой или соединения металла с кислотным оксидом. Соли металлов растворяются в воде и могут образовывать ионы, которые участвуют в химических реакциях и оказывают влияние на физические и химические свойства воды.
Соли металлов также играют важную роль в промышленных процессах и в производстве различных продуктов. Например, хлорид натрия используется в пищевой промышленности в качестве консерванта, а сульфат меди применяется в производстве электроники и красителей.
Щелочные оксиды являются основными оксидами металлов и образуют основные растворы при растворении в воде. Эти оксиды включают гидроксиды щелочных металлов, такие как гидроксид натрия (NaOH) и гидроксид калия (KOH). Щелочные оксиды обладают высокой щелочностью и используются в различных отраслях промышленности, включая производство мыла, стекла и щелочных аккумуляторов.
Щелочные оксиды: определение и характеристика

Щелочные оксиды – это оксиды металлов І группы (группа щелочных металлов в периодической системе химических элементов). Они обладают высокой щелочной реакцией и образуют основания при растворении в воде.
Щелочные оксиды характеризуются следующими свойствами:
- Они обладают низкой температурой плавления и кипения.
- Взаимодействие щелочных оксидов с водой сопровождается интенсивным выделением тепла.
- Щелочные оксиды имеют выраженные щелочные свойства и способны нейтрализовать кислоты. При этом образуются соли и вода.
- Способны образовывать сильнощелочные растворы с высоким показателем рН.
- Большинство щелочных оксидов – это твердые вещества, обладающие металлическим блеском и проводимостью электрического тока.
Примерами щелочных оксидов являются:
- Оксид натрия (Na2O).
- Оксид калия (K2O).
- Оксид лития (Li2O).
- Оксид рубидия (Rb2O).
Щелочные оксиды являются важными компонентами в различных отраслях промышленности. Они находят применение в производстве стекла, мыла, моющих средств, щелочных аккумуляторов и других товаров и материалов. Кроме того, щелочные оксиды широко используются в лабораторных исследованиях и химическом анализе, а также в медицине и косметологии.
Примеры щелочных оксидов

Щелочные оксиды представляют собой химические соединения, которые образуются в результате реакции щелочных металлов с кислородом. Эти соединения обладают щелочными свойствами, то есть они реагируют с водой, образуя гидроксиды и выделяя большое количество теплоты.
Одним из примеров щелочных оксидов является оксид натрия (Na2O). Это белый кристаллический порошок, который образуется при сжигании натрия в атмосфере кислорода. Оксид натрия реагирует с водой, образуя щелочь натрия (NaOH) и выделяя большое количество теплоты. Эта реакция является экзотермической и может использоваться для получения щелочи.
Другим примером щелочного оксида является оксид калия (K2O). Это кристаллическое соединение, которое образуется при сжигании калия в атмосфере кислорода. Оксид калия также реагирует с водой, образуя щелочь калия (KOH) и выделяя теплоту. Это свойство можно использовать для получения гидроксида калия.
Щелочные оксиды также могут быть использованы в промышленности для производства стекла. Соединение оксида натрия обладает свойством понижать температуру плавления, что позволяет снизить энергозатраты при производстве стекла. Оксиды других щелочных металлов, такие как калий и литий, могут также использоваться для изменения свойств стекла и придания ему особых характеристик.
Вопрос-ответ

Какие есть примеры щелочных оксидов?
Примерами щелочных оксидов являются гидроксиды щелочных металлов, такие как гидроксид натрия (NaOH), гидроксид калия (KOH), гидроксид лития (LiOH) и другие.
Для чего используются щелочные оксиды в быту?
Щелочные оксиды, такие как гидроксид натрия и гидроксид калия, широко используются в быту. Гидроксид натрия, или каустическая сода, применяется в производстве мыла, стекла, бытовых и промышленных моющих средств. Гидроксид калия также используется в производстве мыла и других моющих средств, а также в процессе электролиза для получения щелочи.
Какие свойства имеют щелочные оксиды?
Щелочные оксиды обладают рядом характерных свойств. Они растворяются в воде, образуя щелочные растворы. Кроме того, они обладают щелочной реакцией, то есть они обладают способностью нейтрализовать кислоты. Они также являются высокотемпературными оксидами, то есть они образуются при высоких температурах.
Какие применения имеют щелочные оксиды в промышленности?
Щелочные оксиды имеют широкое применение в промышленности. Например, гидроксид натрия используется в производстве бумаги, стекла, мыла, алюминия и других металлов. Гидроксид калия применяется в производстве удобрений, стекла, мыла и других химических продуктов. Гидроксид лития используется в производстве литий-ионных аккумуляторов, стекла и керамики.
