Щелочные металлы - это элементы химической группы I периодической системы элементов. Всего в этой группе насчитывается шесть элементов: литий, натрий, калий, рубидий, цезий и франций. Щелочные металлы являются самыми активными металлами в химическом ряду и обладают рядом особенных свойств.
Литий - самый легкий из щелочных металлов, его плотность составляет всего 0,53 г/см³. Этот элемент обладает большой способностью образовывать неорганические и органические соединения. Литий применяется в производстве легких аккумуляторов, стекла и керамики, а также в производстве алюминия и магния.
Натрий - второй элемент щелочных металлов, его плотность равна 0,97 г/см³. В природе натрий встречается в виде хлорида натрия - обычной столовой соли. Этот элемент является очень важным для многих биологических процессов в организмах живых существ. Натрий также используется в производстве стекла, мыла, щелочи, а также в пищевой промышленности, для консервирования и приготовления пищи.
Калий - третий элемент щелочных металлов, его плотность составляет 0,86 г/см³. Калий находится в больших количествах в почве и в морской воде. Он играет важную роль в регуляции водного баланса организма, а также в работе мышц и нервной системы. Калий используется в производстве удобрений, стекла, мыла, а также в производстве легких металлических сплавов и щелочных элементов аккумуляторов.
Примеры реактивности щелочных металлов
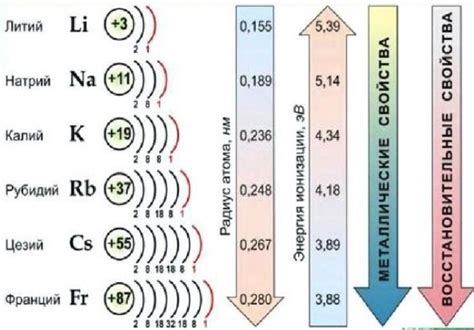
Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и др., обладают высокой реактивностью из-за своей низкой ионизационной энергии и способности легко отдавать электроны.
Один из примеров реактивности щелочных металлов - их реакция с водой. В результате такой реакции происходит образование щелочных гидроксидов и выделение водорода. Например, литий реагирует с водой по следующему уравнению:
2Li + 2H2O → 2LiOH + H2
Другой пример реактивности - реакция щелочных металлов с кислородом. Воздействие кислорода на щелочные металлы приводит к образованию оксидов металла. Например, реакция натрия с кислородом выглядит следующим образом:
4Na + O2 → 2Na2O
Еще одной реакцией, иллюстрирующей высокую реактивность щелочных металлов, является их взаимодействие с хлором. В результате возникает образование хлоридов металлов. Например, реакция калия с хлором:
2K + Cl2 → 2KCl
Также, щелочные металлы проявляют реактивность при реакции с кислотами. В результате образуются соли и выделяется водород. Например, реакция калия с серной кислотой:
2K + H2SO4 → K2SO4 + H2
Таким образом, реактивность щелочных металлов проявляется во взаимодействии с водой, кислородом и кислотами, что делает их важными веществами для различных процессов и применений.
Свинец, медь и никель как примеры реактивности щелочных металлов

Щелочные металлы, такие как литий, натрий и калий, характеризуются высокой реактивностью в контакте с водой и кислородом. Однако есть и другие металлы, которые, хоть и не являются чистыми представителями щелочных металлов, также проявляют реакцию взаимодействия со средами.
Свинец, например, не является щелочным металлом, но его свойства позволяют ему некоторые проявления, свойственные щелочным металлам. Свинец может вступать в реакцию с кислородом и образовывать окись свинца (PbO), которая обычно имеет желто-красный цвет. Также, под воздействием сильных оснований, свинец может реагировать и образовывать свои соли.
Медь, с другой стороны, является переходным металлом и не относится к щелочным металлам. Однако она также может проявлять свою реактивность при взаимодействии с различными веществами. Например, медь активно реагирует с кислородом и водой, образуя оксид меди (CuO) и гидроксид меди (Cu(OH)2). Подобно щелочным металлам, медь также образует легко растворимые соли в результате реакции с кислотами.
Никель, как и свинец и медь, не является чистым представителем щелочных металлов, но также проявляет некоторую реактивность. Например, никель может реагировать с кислородом и водой, образуя соответственно оксид никеля (NiO) и гидроксид никеля (Ni(OH)2). Растворимые соли никеля также образуются при реакции с кислотами.
Железо и цинк в качестве других примеров реактивности щелочных металлов

Железо и цинк являются металлами, которые также проявляют определенную степень реактивности, подобную щелочным металлам. Хотя они не относятся к классу щелочных металлов, они все же обладают сходными свойствами и могут примерно реагировать так же.
Железо является важным элементом в ряде биологических процессов, однако оно также может быть очень реактивным, особенно в присутствии кислорода и влаги. При окислении железа создается ржавчина, которая является результатом химической реакции с водой и кислородом, приводящей к образованию гидроксида железа (III). Эта реакция хорошо известна и широко наблюдается в повседневной жизни.
Цинк также обладает реактивностью, хотя в меньшей степени, чем щелочные металлы. Он может реагировать с кислотами и создавать соль цинка и водород. Например, реакция между цинком и соляной кислотой приводит к образованию хлорида цинка и выделению водорода. Это также широко используется в лаборатории и промышленности, а также может быть наблюдаемо в некоторых бытовых ситуациях.
Таким образом, даже не являясь щелочными металлами, железо и цинк могут служить примерами реактивности и подобных химических свойств, которые проявляют щелочные металлы. Это демонстрирует, насколько разнообразными и интересными могут быть химические реакции и свойства различных элементов в периодической таблице.
Примеры применения щелочных металлов в промышленности

Щелочные металлы, такие как литий, натрий и калий, имеют широкое применение в различных отраслях промышленности благодаря своим особым химическим свойствам.
1. Пищевая и напитковая промышленность.
Натрий-калиевые сплавы используются для производства пищевых добавок и консервантов. Натрий широко применяется для поддержания уровня pH в процессе производства пищевых продуктов и напитков. Литий используется в производстве безалкогольных напитков, освежающих напитков и сладостей.
2. Металлургия и электроника.
Натрий и калий являются важными компонентами в процессах производства стали и алюминия. Они способствуют повышению эффективности плавки металлов и улучшению их характеристик. Литий используется в производстве легких, прочных и стабильных металлических сплавов, которые применяются в производстве электроники и аккумуляторов.
3. Энергетика.
Литиевые ионные аккумуляторы являются центральным компонентом в производстве мобильных устройств, электромобилей, солнечных батарей и других источников энергии. Литий обладает высокой энергоемкостью и длительным сроком службы, что делает его идеальным решением для современных технологий хранения энергии.
4. Фармацевтическая промышленность.
Литий используется в производстве лекарственных препаратов для лечения психических заболеваний, таких как биполярное расстройство и депрессия. Литийовые соли имеют успокаивающее и антидепрессантное действие, что помогает пациентам справиться с симптомами этих заболеваний.
Щелочные металлы являются неотъемлемыми составляющими в различных областях промышленности и продолжают находить новые применения в современных технологиях. Благодаря их уникальным свойствам, эти металлы играют важную роль в улучшении качества жизни и развитии промышленности.
Использование натрия и калия в производстве стекла и мыла

Натрий и калий – два основных щелочных металла, которые находят широкое применение в различных отраслях промышленности. Одними из распространенных областей использования этих металлов являются производство стекла и мыла.
Производство стекла:
Натрий и калий используются в процессе производства различных видов стекла. Они являются основными компонентами стеклянных смесей и играют важную роль в формировании его химической структуры и физических свойств. Натрий обеспечивает прозрачность стекла, а также повышает его пластичность и плавучесть. Калий влияет на устойчивость стекла к воздействию воды, кислот и других химических веществ. Благодаря своим свойствам, натрий и калий позволяют создавать разнообразные формы и изделия из стекла.
Производство мыла:
Натрий и калий применяются в процессе производства различных видов мыла. Щелочные металлы используются в качестве основного компонента при изготовлении щелочных растворов, которые затем соединяют с жиром или маслом. Взаимодействие натрия или калия с жиром приводит к процессу сапонификации, в результате которого образуется мыло. Отличительной особенностью мыла, полученного на основе натрия или калия, является его способность эффективно очищать поверхность кожи и удалить загрязнения.
Таким образом, натрий и калий играют важную роль в производстве стекла и мыла благодаря своим особенностям и свойствам. Их использование позволяет создавать высококачественные и функциональные продукты, которые широко применяются в повседневной жизни.
Вопрос-ответ

Какие металлы относятся к щелочным?
К щелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Какие свойства имеют щелочные металлы?
Щелочные металлы обладают следующими основными свойствами: низкой плотностью, низкой температурой плавления, низкой твердостью, высокой химической реактивностью, тенденцией к образованию ионов M+, образованием гидроксида щелочного металла при реакции с водой и образованием оксида щелочного металла при реакции с кислородом.
Какие примеры использования щелочных металлов в повседневной жизни?
Щелочные металлы широко используются в повседневной жизни. Например, натрий используется в производстве стекла и мыла, калий используется в удобрениях, рубидий используется в электронике и лазерных устройствах, литий используется в аккумуляторах и металлографии.
Какие опасности связаны с использованием щелочных металлов?
Использование щелочных металлов может быть опасным из-за их высокой реактивности. Они могут вызывать химические ожоги при контакте с кожей и глазами, а при реакции с водой могут выделяться горючие газы. Следует соблюдать осторожность при работе с ними и использовать соответствующие средства индивидуальной защиты.
