В химии есть несколько основных групп элементов, которые нужно знать, чтобы понимать, как происходят реакции между веществами. Одна такая группа - группа щелочных металлов. Эти элементы находятся в первой группе периодической системы Менделеева и обладают общими свойствами.
Первый элемент группы щелочных металлов - литий. Он обладает металлическим блеском и является наиболее легким металлом. Литий используется в производстве аккумуляторов для мобильных телефонов и лаптопов, а также в некоторых лекарствах.
Второй элемент группы - натрий. Он широко распространен в природе и является важным элементом для живых организмов. Натрий содержится в соли, которую мы употребляем в пищу. Также натрий используется для производства горячих металлов, стекла и щелочей.
Третий элемент группы - калий. Он также важен для живых существ и играет ключевую роль в функционировании мышц и нервной системы. Калий содержится во многих продуктах, таких как бананы, картофель и молоко. Он также используется в производстве удобрений.
Группа щелочных металлов имеет много интересных свойств и применений. Изучение этих элементов поможет учащимся понять, как работает химия в повседневной жизни и применить свои знания на практике.
Что такое щелочные металлы?
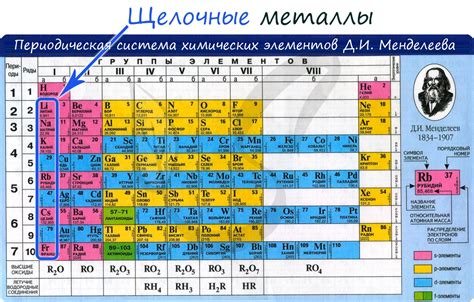
Щелочные металлы - это элементы, принадлежащие к первой группе периодической системы элементов. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы получили свое название из-за свойств образования щелочных растворов, обладающих щелочным (основным) pH.
Щелочные металлы имеют низкую плотность, низкую температуру плавления и кипения, а также низкую твердость, что делает их мягкими и легко режущимися металлами. Они обладают высокой реактивностью и легко реагируют с водой, кислородом и другими элементами.
Литий, натрий и калий находят широкое применение в различных отраслях промышленности и научных исследованиях. Например, литий используется в производстве лекарств, аккумуляторов и ядерных реакторов. Натрий применяется в производстве стекла, мыла и соды, а калий - в удобрениях и жидкостях отмерзания дорог.
Рубидий, цезий и франций, в свою очередь, являются редкими и очень дорогими элементами. Они находят ограниченное применение в научных исследованиях, включая использование их в атомных часах и в особых типах лазеров.
Химические свойства щелочных металлов

Щелочные металлы представляют собой группу элементов периодической системы, включающую литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они обладают рядом химических свойств, которые делают их уникальными и важными для нашей жизни.
Реакционная способность щелочных металлов является одним из их основных химических свойств. Они легко реагируют с водой, выделяясь водородом и образуя гидроксиды. Например, натрий и вода образуют гидроксид натрия и водород, что сопровождается выделением большого количества тепла. Эта реакция часто используется для получения водорода и гидроксидов щелочных металлов.
Окислительные свойства щелочных металлов тоже являются важными. Они способны вступать в реакции с кислородом, образуя оксиды. Литий, например, может образовывать оксид лития (Li2O) в результате реакции с кислородом воздуха. Это окислительное действие относится к свойствам, которые делают щелочные металлы полезными в различных отраслях промышленности.
Способность образовывать соли также является химическим свойством щелочных металлов. Они легко образуют соли со многими кислотами, такими как серная кислота (H2SO4), соляная кислота (HCl) и другими. Эти соли широко применяются в различных сферах жизни, включая производство удобрений, стекла и мыла.
Реактивность щелочных металлов по отношению к веществам, таким как хлор (Cl2), фтор (F2) и бром (Br2), также является важным свойством. Они способны реагировать с этими галогенами, образуя соли галогениды. Например, натрий и хлор образуют хлорид натрия (NaCl), который является одним из самых распространенных и известных солей.
Химические свойства щелочных металлов делают их важными в различных областях науки и промышленности. Их способность к реакциям с водой, кислородом и другими химическими веществами позволяет использовать их в процессах производства, синтеза веществ, а также для создания различных продуктов и материалов, которые используются в повседневной жизни.
Химические элементы группы 1

Группа 1 периодической таблицы элементов, также известная как группа щелочных металлов, состоит из шести химических элементов: лития, натрия, калия, рубидия, цезия и франция.
Щелочные металлы обладают рядом общих свойств, которые их отличают от других элементов. Они являются очень реактивными металлами, легко реагирующими с водой и кислородом. Кроме того, они имеют низкую плотность и низкую температуру плавления. Каждый из щелочных металлов имеет свои уникальные свойства и применения в различных отраслях промышленности и научных исследованиях.
Литий является самым легким металлом в группе 1. Он используется в производстве легких и прочных металлических сплавов, а также в производстве аккумуляторов и лекарственных препаратов.
Натрий является очень распространенным элементом в земной коре. Он широко используется в пищевой промышленности для консервации и прибавления вкуса пище. Натрий также используется в производстве стекла, мыла и многих других продуктов.
Калий встречается в природе в виде солей, например, в пищевой соли и удобрениях. Он играет важную роль в регуляции водного и минерального баланса в организмах животных и человека. Калий также используется в производстве стекла, мыла и удобрений.
Рубидий и цезий являются редкими элементами, но они находят применение в высокоэффективных солнечных батареях и атомных часах. Они также могут быть использованы в научных исследованиях и разработках.
Франций является самым редким и растворимым из всех щелочных металлов. Он имеет очень короткое время полужизни и является радиоактивным элементом. Франций практически не находит применения в промышленности, но является предметом научных исследований из-за своей уникальной природы.
Изучение щелочных металлов группы 1 важно для понимания химических свойств и применения этих элементов в жизни. Они играют важную роль в научных исследованиях, промышленности и медицине, и их уникальные свойства делают их ценными материалами в различных областях.
Свойства и примеры лития

Литий - это металл, химический элемент из группы щелочных металлов. Он обладает низкой плотностью и является самым легким из всех металлов. Его атомный номер равен 3, а атомная масса около 6.94 г/моль.
Литий обладает рядом уникальных свойств. Во-первых, он очень реактивен и быстро окисляется на воздухе. Во-вторых, он очень низкой плотности и мягкий, что позволяет его нарезать ножом и даже резать некоторые воздушные пузыри на поверхности воды. Также литий обладает высокой электропроводностью и используется в производстве аккумуляторов и других электронных устройств.
Примеры соединений лития включают литиевый гидроксид (LiOH), который используется в качестве щелочи, литиевый алюминиевый гидрид (LiAlH4), который используется как сильное вещество восстановления, и литиевый ионный аккумулятор, который является основной технологией современных портативных электронных устройств.
Свойства и примеры натрия

Натрий - это щелочной металл, который относится к первой группе периодической системы химических элементов. Он имеет атомный номер 11 и символ Na. Натрий достаточно распространен и встречается в природе в виде различных соединений, таких как соль и минералы.
Вот некоторые свойства натрия:
- Атомный радиус: атомный радиус натрия составляет около 186 пикометров, что делает его более крупным по сравнению с большинством других элементов.
- Мягкий металл: натрий является металлом мягкой консистенции и может быть нарезан ножом. Он также обладает серебристо-белым цветом.
- Реактивность: натрий является очень реактивным металлом и легко вступает в реакцию с водой или кислородом. При контакте с водой выделяется водородный газ.
- Использование: натрий имеет широкий спектр применений. Он используется в производстве осветительных приборов, в процессе сплавления металлов, в производстве мыла и стекла, а также в пищевой промышленности.
Некоторые примеры соединений натрия включают:
- Натрий хлорид (NaCl) - обычная кухонная соль, которая используется в пищевой промышленности для соления и приготовления пищи.
- Гидроксид натрия (NaOH) - щелочное вещество, широко используемое в бытовых и промышленных целях, включая производство мыла и очистку сточных вод.
- Карбонат натрия (Na2CO3) - растворимое вещество, используемое в производстве стекла, моющих средств и водоочистке.
- Бикарбонат натрия (NaHCO3) - также известный как пищевая сода, широко используется в приготовлении теста и очищении.
Это лишь некоторые примеры свойств и соединений натрия, которые можно изучить в 9 классе.
Свойства и примеры калия

Калий - щелочной металл, атомный номер которого равен 19. Он обладает мягкой и серебристо-белой металлической поверхностью, которая быстро окисляется на воздухе.
Калий хорошо растворяется в воде и является активным элементом. Он реагирует с водой возникновением водорода и образованием щелочи. Калий - один из самых важных элементов для многих живых организмов, включая растения и животных.
Благодаря своей активности, калий используется во многих промышленных и химических процессах. Он широко применяется в производстве удобрений для повышения плодородия почвы и улучшения роста растений.
Калий также используется в производстве различных химических соединений и солей, таких как хлорид калия и карбонат калия. Они находят применение в фармацевтике, стекольной промышленности, производстве мыла и многих других отраслях.
Некоторые примеры соединений калия:
- Калия нитрат (KNO3) - применяется в производстве пороха и других взрывчатых веществ.
- Калия гидроксид (KOH) - известен как каустическая сода, используется в промышленности, включая производство мыла и отчистку воды.
- Калия перманганат (KMnO4) - используется в медицине как антисептик и окислитель, а также в химических лабораториях.
- Калия хлорат (KClO3) - применяется в пиротехнике и производстве стекла.
Калий имеет важное значение в живых организмах и промышленности, и его соединения находят применение во многих сферах жизни.
Свойства и примеры рубидия
Рубидий - это алкалийский металл, который находится в первой группе периодической системы элементов. Он обладает химическим символом Rb и атомным номером 37. Рубидий является мягким и серебристо-белым металлом, который легко окисляется на воздухе. Он имеет низкую плотность и низкую температуру плавления.
Одним из основных свойств рубидия является его высокая реактивность. Он активно реагирует с водой, выделяя водород и образуя рубидиевую щелочь. Рубидиевая щелочь является сильной щелочью и имеет широкий спектр применений, включая производство лекарственных препаратов и в качестве катализатора в химических процессах.
Рубидий также служит важным компонентом в электротехнике и электронике. Он используется в приборах и приборах для создания стабильных электрических сигналов. Благодаря своим электрохимическим свойствам рубидий находит применение в конструкции электролитических клеток и солевых аккумуляторов.
Интересное свойство рубидия - его способность испускать интенсивно красный цвет при нагревании. Это свойство находит применение в производстве расплавленного стекла и в производстве огненных фейерверков.
Примерами соединений с рубидием являются рубидиевый цианид (RbCN), рубидиевый гидроксид (RbOH) и рубидиевая селитра (RbNO3). Рубидиевые соединения используются в различных областях, включая производство стекла, керамики и катализаторов в химической промышленности.
Свойства и примеры цезия

Цезий - химический элемент с атомным номером 55 и символом Cs. Он является мягким и сильно реактивным металлом, который обладает специфическими свойствами.
Физические свойства цезия:
- Цезий имеет серебристо-белый цвет и мягкую консистенцию.
- Он обладает плотностью, которая ниже, чем у воды.
- Точка плавления цезия составляет около 28,4 градусов Цельсия.
- Цезий входит в число самых реактивных щелочных металлов и реагирует с водой с выделением водорода.
Химические свойства цезия:
- Цезий является наиболее электроположительным элементом и может легко образовывать ионы Cs+.
- Он обладает низким электроотрицательностью, что делает его химически очень активным.
- Цезий может образовывать различные соединения, включая хлорид, бромид, йодид, фосфат и другие.
Примеры применения цезия:
- Цезий используется в вакуумных трубках, так как его ионизация очень легка.
- Он широко применяется в атомных часах, так как его атомы имеют особую способность сохранять постоянную частоту излучения.
- Цезий используется в некоторых медицинских процедурах, таких как радиотерапия и диагностические методы.
В целом, цезий является важным элементом в различных областях науки и технологии благодаря своим уникальным свойствам и применению в различных процессах.
Вопрос-ответ

Какие щелочные металлы есть и зачем их нужно знать в 9 классе?
В 9 классе ученики изучают химию и щелочные металлы являются одной из важных групп элементов. Щелочные металлы включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Знание этих элементов позволяет ученикам понять основные свойства и химические реакции, в которых они участвуют. Например, щелочные металлы обладают высокой активностью и реагируют с водой, кислородом и другими веществами.
Какие уникальные свойства имеют щелочные металлы?
У щелочных металлов есть несколько уникальных свойств. Во-первых, они являются очень реакционноспособными и легко взаимодействуют с водой, образуя гидроксиды и высвобождая водород. Они также реагируют с кислородом из воздуха, образуя оксиды. Во-вторых, щелочные металлы имеют низкую плотность, что делает их легкими для работы. Они также обладают низкой температурой плавления и кипения.
Какие элементы входят в группу щелочных металлов и как они применяются в жизни?
Группу щелочных металлов составляют литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти металлы находят широкое применение в различных областях жизни. Например, натрий используется в пищевой промышленности для приготовления пищевых добавок и консервирования продуктов. Калий используется в сельском хозяйстве в качестве удобрения для растений. Литий применяется в производстве аккумуляторов и лекарственных препаратов. Рубидий, цезий и франций находят применение в научных исследованиях и разработке специальных устройств.
