Щелочные металлы – это группа элементов периодической системы, которая включает литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они отличаются высокой активностью и являются самыми реактивными металлами. Одной из наиболее известных и важных реакций щелочных металлов является их реакция с водой.
Когда щелочные металлы вступают в контакт с водой, происходит быстрая и интенсивная реакция. В результате этой реакции образуется гидроксид металла и выделяется водород. Сила реакции с водой зависит от элемента и увеличивается по мере движения вниз по группе щелочных металлов. Например, литий реагирует с водой тихо и медленно, в то время как реакция цезия с водой является взрывоопасной.
Эта реакция имеет особую важность в научных и промышленных приложениях. Она широко используется для производства водорода, который является важным источником энергии и используется в физических и химических процессах. Кроме того, реакция щелочных металлов с водой является частым объектом исследований в области химии и физики.
Таким образом, реакция щелочных металлов с водой представляет собой важный физический и химический процесс, который имеет множество практических применений и вызывает большой интерес среди ученых в области науки о веществе.
Свойства щелочных металлов

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают рядом характерных свойств, которые делают их особенными среди других элементов. Эти металлы имеют низкую плотность и низкую температуру плавления, что делает их легкими и плавучими на воде.
Одной из особенностей щелочных металлов является их реакция с водой. Когда они контактируют с водой, происходит быстрая и интенсивная реакция, сопровождающаяся выделением водорода и образованием щелочной среды. Это связано с тем, что щелочные металлы имеют низкую электроотрицательность и легко отдают свои электроны в реакции.
Щелочные металлы также обладают высокой реакционной способностью. Они легко реагируют с кислородом, галогенами и другими веществами. Благодаря этим свойствам, щелочные металлы широко используются в промышленности и научных исследованиях.
Другим важным свойством щелочных металлов является их способность образовывать ионы с однозарядным положительным зарядом. Это делает их хорошими ионными проводниками и электролитами. Ими можно заполнять электролитические клетки и использовать в батареях и аккумуляторах.
Итак, свойства щелочных металлов, такие как низкая плотность, высокая реакционная способность, способность образовывать щелочные растворы и использоваться как ионные проводники, делают их важными и интересными элементами в химии и промышленности.
Особенности химического состава

Щелочные металлы относятся к элементам первой группы периодической таблицы, включая литий, натрий, калий, рубидий и цезий. Химический состав этих элементов характеризуется наличием одного электрона в самой внешней энергетической оболочке. Данная особенность делает щелочные металлы очень реакционноспособными и склонными к образованию оксидов, гидроксидов и солей.
Например, литий и натрий являются самыми активными щелочными металлами, так как они легко отдают свой электрон при взаимодействии с другими элементами. Калий, рубидий и цезий также обладают высокой активностью, но несколько меньшей, чем литий и натрий.
Взаимодействие щелочных металлов с водой является одним из наиболее характерных проявлений их химического состава. При реакции с водой щелочные металлы образуют гидроксиды, при этом выделяется водород. Процесс реакции с водой ускоряется взаимодействием с кислородом воздуха.
Одной из особенностей химического состава щелочных металлов является также их способность образовывать соединения с атомами других элементов, что проявляется при образовании солей. Например, калий реагирует с хлором, образуя хлорид калия. Это свойство щелочных металлов используется не только в химии, но и в различных технологических и промышленных процессах.
Физические характеристики и важность в промышленности

Щелочные металлы - это элементы, которые находятся в первой группе периодической системы. Они включают в себя литий, натрий, калий, рубидий и цезий. Эти металлы обладают рядом уникальных физических характеристик, которые делают их важными в промышленности.
Во-первых, щелочные металлы обладают низкой плотностью, что означает, что они легкие и могут использоваться для создания легких материалов и конструкций. Это особенно важно в авиационной и автомобильной промышленности, где вес играет решающую роль в эффективности и производительности транспортных средств.
Кроме того, щелочные металлы обладают высокой теплопроводностью, что делает их полезными в различных теплообменных системах и электронных устройствах. Например, натрий используется в производстве жидкометаллических теплоносителей для ядерных реакторов, а калий применяется в производстве калиевых батарей для хранения энергии.
Кроме того, щелочные металлы обладают высокими электрическими и тепловыми проводимостями, что делает их идеальными для использования в электротехнике и электронике. Например, литий используется в производстве литий-ионных аккумуляторов, которые широко применяются в портативных электронных устройствах, таких как смартфоны и ноутбуки.
В целом, щелочные металлы являются важными компонентами в промышленности благодаря своим уникальным физическим характеристикам. Они нашли широкое применение в различных отраслях, начиная от авиации и автопрома до электротехники и энергетики.
Реакция щелочных металлов с водой

Щелочные металлы, такие как литий, натрий, калий и другие, обладают химической особенностью – они реагируют с водой, образуя щелочь и выделяя водород. Эта реакция является одной из важнейших характеристик этих металлов и имеет свои особенности.
Когда один из щелочных металлов погружают в воду, происходит быстрая и интенсивная реакция. Металл начинает активно образовывать гидроксид (щелочь) и выделяться водородный газ. Скорость реакции зависит от концентрации металла и температуры воды.
Процесс реакции щелочных металлов с водой можно представить с помощью химического уравнения. Например, калий реагирует с водой следующим образом:
2K(s) + 2H₂O(l) → 2KOH(aq) + H₂(g)
Это уравнение показывает, что два атома калия (K) реагируют с двумя молекулами воды (H₂O) и образуют две молекулы калиевого гидроксида (KOH) и одну молекулу водорода (H₂).
Реакция щелочных металлов с водой сопровождается интенсивным выделением водорода, что делает ее легко заметной. При этом щелочная среда, образовавшаяся в результате реакции, обладает щелочными свойствами и может оказывать влияние на окружающую среду.
В заключение, реакция щелочных металлов с водой представляет собой процесс образования гидроксида и выделения водорода. Она является характерной особенностью щелочных металлов и имеет большое значение в химии и промышленности.
Механизм реакции

Реакция щелочных металлов с водой происходит в несколько этапов и имеет сложный механизм. Первоначально, металлные атомы покидают поверхность металла и вступают в реакцию с молекулами воды. В процессе реакции происходит образование ионов гидроксида и выделение водорода. Механизм данной реакции может быть представлен следующим образом:
- Металлический катион проникает в решетку воды.
- Катион гидроксида, образующийся в результате реакции, реагирует с молекулами воды, образуя молекулы гидроксида.
- Ионы гидроксида и ионы гидрона добавляются в раствор, образуя гидроксидно-гидрониевую среду.
- Выделяется водород, который может быть улавливаем или сгореть в результате реакции с кислородом.
В результате данной реакции образуется гидроксид щелочного металла и выделяется водород. Процессы реакции могут быть различными в зависимости от конкретного щелочного металла, его концентрации и условий проведения реакции.
Примеры исключений
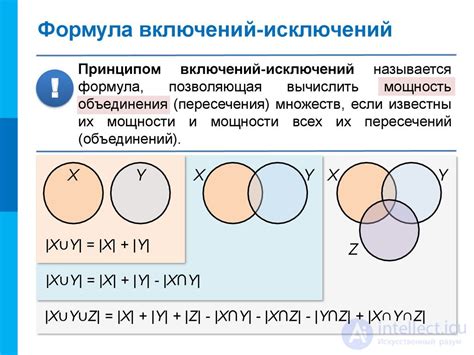
Хотя большинство щелочных металлов реагируют с водой, существуют несколько исключений, которые обладают некоторыми особенностями. Например, литий, наименьший щелочный металл, несколько отличается от остальных членов этой группы.
В отличие от других щелочных металлов, литий образует покрытие оксида на поверхности, которое защищает его от дальнейшего контакта с водой. Это означает, что реакция лития с водой протекает медленно и менее явно, чем у остальных щелочных металлов.
Калий и некоторые другие щелочные металлы также могут образовывать покрытие оксида на поверхности, но оно не является настолько прочным, как покрытие оксида лития. Это приводит к более интенсивной реакции с водой у этих металлов.
Некоторые щелочные металлы, такие как рубидий и цезий, могут реагировать с водой и образовывать газообразные вещества, такие как водород и гидроксид металла. Это может происходить с большим выделением тепла и образованием яркого пламени.
Вопрос-ответ

Какие элементы относятся к щелочным металлам?
К щелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Что происходит при реакции щелочных металлов с водой?
При реакции щелочных металлов с водой происходит образование щелочного гидроксида и выделение водорода.
Каковы особенности реакции лития с водой?
Особенностью реакции лития с водой является ее очень быстрое и интенсивное протекание. При контакте лития с водой происходит яркое горение металла, а также выделение большого количества водорода.
Какие особенности имеет реакция калия с водой?
Особенностью реакции калия с водой является очень интенсивное горение металла и выделение большого количества тепла и света. При этом, реакция происходит с шипением и выделением пурпурного пламени.
Какие могут быть примеры реакции натрия с водой?
Примерами реакции натрия с водой могут быть образование натриевого гидроксида (NaOH) и выделение водорода. Также возможны дополнительные реакции, например, образование гидроксида натрия и образование гидрогидрата натрия.
