Реакция воды с металлами является одной из основных химических реакций и имеет важное значение в химии. Водородная реакция, происходящая при контакте воды с некоторыми металлами, является классическим примером этого типа химической реакции.
При контакте воды с металлами, такими как натрий и калий, происходит интенсивное выделение водорода. Это связано с тем, что вода взаимодействует с металлом, образуя металлический гидроксид и выделяя водород. Например, реакция между металлическим натрием и водой протекает по следующей схеме:
2Na + 2H2O → 2NaOH + H2
В результате данной реакции образуется гидроксид натрия (NaOH) и выделяется водород (H2). Такая реакция имеет сильно выраженный взрывоопасный характер, поэтому ее проведение необходимо выполнять с особыми мерами предосторожности.
Кроме натрия и калия, возможна реакция воды с другими металлами, например, с металлическими элементами из группы щелочноземельных металлов – магнием, кальцием и другими. Однако, при реакции с этими металлами образуется менее интенсивное выделение водорода. Вместо этого образуется гидроксид металла и выделяется газообразный водород. Таким образом, реакция воды с металлами представляет собой важный процесс в химии, в котором образуются не только новые вещества, но и выделяется важный для нас газ.
Вода и металлы: реакции и соединения
Реакция воды с металлами – это процесс, в результате которого образуются соединения между металлом и водой. Эти реакции часто сопровождаются выделением газов в виде пузырьков и образованием характерных осадков.
Одним из примеров реакции воды с металлами является реакция натрия с водой. В результате этой реакции образуются гидроксид натрия (NaOH) и выделяется водородный газ (H2). Реакция также сопровождается сильным нагреванием и последующим горением выделяющегося водорода.
Ещё одним примером реакции является реакция алюминия с водой. При контакте алюминия с водой образуется оксид алюминия (Al2O3) и образуется водородный газ (H2). В данном случае реакция протекает медленнее, чем реакция натрия с водой, так как на поверхности алюминия образуется тонкая пленка оксида, которая затрудняет дальнейшее проникновение воды.
Особенностью реакций воды с металлами является их способность вызывать коррозию металла. Вода является проводником электричества и взаимодействие металла с водой приводит к образованию электролитической ячейки, что ускоряет процесс окисления металла.
Основные свойства воды и металлов:
Вода – это вещество, характеризующееся относительно низкой плотностью и высокой плавучестью. Ее молекулы обладают полярностью, что обуславливает множество особенностей данного вещества. Вода обладает уникальной способностью изменять свою агрегатную форму, переходя от жидкости к твердому состоянию (лед) или газообразному состоянию (пар). Кроме того, она является прекрасным растворителем и обладает возможностью проявлять различные физические и химические свойства.
Металлы – это химические элементы, которые характеризуются высокой теплопроводностью, электропроводностью и прочностью. В основном они представлены в виде твердых веществ с металлическим блеском. Металлы обладают способностью образовывать ионные соединения с многими другими веществами, включая воду. В результате реакции с водой, некоторые металлы, такие как натрий, калий или магний, способны выделять водородный газ и образовывать гидроксиды.
Таким образом, основные свойства воды и металлов определяют направление и характер реакций между ними. В случае реакции металлов с водой, металлы вступают в активное взаимодействие с молекулами воды, приводя к образованию гидроксидов металлов и выделению водородного газа. Реакция между металлами и водой может быть сопровождена погружением металла в воду, образованием пузырьков газа или энергичным выделением тепла. Особенности реакции зависят от свойств металла и его активности.
Электролиз воды: процесс и примеры
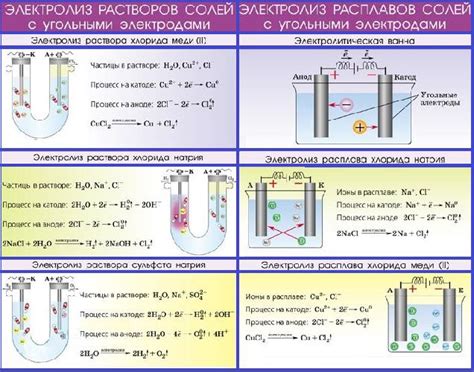
Электролиз воды - это процесс разложения воды на составляющие ее элементы - водород и кислород - под воздействием электрического тока.
Технический электролиз воды часто проводится в специальных установках, в которых используются электроды и электролиты. Одним из примеров таких установок является электролизер. В электролизере вода разлагается на положительно заряженные ионы водорода (H+) и отрицательно заряженные ионы гидроксила (OH-). Эти ионы перемещаются к электродам, где происходят окислительно-восстановительные реакции.
Процесс электролиза воды подразделяется на две части: окисление на аноде и восстановление на катоде. На аноде происходит окисление воды с образованием кислорода (O2) и ионов гидроксила. На катоде происходит восстановление ионов водорода, которые соединяются между собой, образуя молекулы водорода (H2).
Проведение электролиза воды имеет большое практическое значение. Один из основных способов производства водорода - это электролиз воды. Также электролиз воды используется для получения кислорода, водородной пероксида и других веществ.
Реакции воды с активными металлами

Реакции воды с активными металлами являются одним из основных примеров химических реакций. Активные металлы, такие как натрий, калий, литий и другие, обладают высокой реакционной способностью с водой.
Когда активный металл вступает в контакт с водой, происходит экзотермическая реакция, сопровождающаяся выделением тепла и образованием газообразных продуктов. В результате реакции металл расщепляется на ионы источника металла и водород, который выделяется в виде пузырьков.
Процесс взаимодействия металла с водой также может приводить к образованию щелочных растворов, основанных на ионах металла. Например, реакция натрия с водой приводит к образованию гидроксида натрия, NaOH. Это объясняет щелочную среду, которая возникает после реакции активного металла с водой.
Реактивность активных металлов с водой напрямую связана с их электрохимическим потенциалом. Чем ниже электрохимический потенциал металла, тем более активно он реагирует с водой. Например, калий, обладающий самым низким электрохимическим потенциалом среди активных металлов, является наиболее реакционноспособным в воде.
Реакции активных металлов с водой широко используются в различных областях, включая химическую промышленность и энергетику. Например, применение натрия для получения водорода является подходящим способом производства этого газа. Кроме того, реакция активных металлов с водой является одним из источников энергии для различных типов батарей.
Образование оксидов при взаимодействии воды с металлами
Вода, как реактив, может взаимодействовать с металлами и приводить к образованию оксидов. Это явление особенно хорошо изучено в химии и широко применимо в различных отраслях науки и промышленности.
Во время реакции металлов с водой происходит окисление металла, при котором он образует оксид. Образование оксидов может происходить на поверхности металла или в виде частиц, которые растворяются в воде. При этом, металлы, которые более активны в ряду реактивности, более быстро и интенсивно взаимодействуют с водой.
Например, алкалийные металлы, такие, как калий или натрий, реагируют с водой очень быстро и образуют оксиды, такие как оксид калия или оксид натрия. При этом, реакция с водой может быть настолько интенсивной, что металл может воспламениться или даже взорваться.
Более редкие металлы, например, магний или алюминий, тоже могут образовывать оксиды при контакте с водой, но реакция проходит уже на порядок медленнее, чем с алкалийными металлами. При этом, оксиды этих металлов могут образовывать защитные пленки на их поверхности, что препятствует дальнейшему окислению и реакции с водой.
Таким образом, образование оксидов при взаимодействии воды с металлами является важным и интересным явлением химических реакций. Изучение этого процесса позволяет лучше понять свойства и химическую активность металлов, а также разрабатывать новые применения их соединений.
Водородное сгорание и образование водорода при взаимодействии воды с металлами
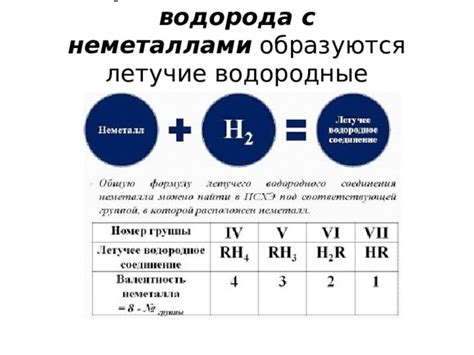
Водородное сгорание – это реакция между водородом и кислородом, при которой образуется вода. Однако водород может сгорать не только с кислородом, но и с другими элементами, такими как металлы. Взаимодействие воды с металлами приводит к образованию водорода.
Металлы, которые реагируют с водой, обладают высокой активностью, так как способны отдавать электроны. При контакте с водой металлы вступают в реакцию, в результате которой образуется гидроксид металла и водородный газ.
Образование водорода при взаимодействии воды с металлами можно проиллюстрировать на примере реакции цинка с водой:
- Цинк реагирует с молекулами воды, образуя гидроксид цинка.
- Отделяющиеся в результате реакции электроны передаются на кислородные атомы воды, образуя гидроксид и водородный газ.
- Получившийся водородный газ выделяется в виде пузырьков.
Реакция металлов с водой является экзотермической, то есть сопровождается выделением тепла. В некоторых случаях реакция может протекать очень быстро и сопровождаться шумом и искрами.
Растворение металлов в воде и образование солей
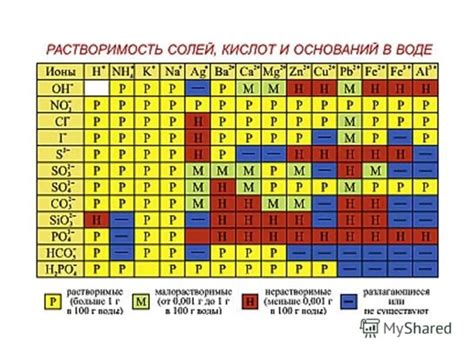
Растворение металлов в воде – это процесс, при котором металлические ионы переходят в раствор. Реакция металлов с водой может протекать различными способами и зависит от их активности. Растворение некоторых металлов происходит мгновенно и с выделением газа, в то время как у других металлов это происходит намного медленнее.
Вода может растворять металлы, образуя соли, в которых металл замещает водород. Это связано с энергетическими характеристиками реакции, а также химической активностью металлов. Наиболее активные металлы, такие как щелочные и щелочноземельные металлы, растворяются в воде быстро и образуют основания.
Растворение металлов в воде является реакцией окисления, при которой металл отдает электроны, а вода принимает эти электроны. В результате образуются положительно заряженные металлические ионы и негативно заряженные ионы гидроксида.
Особенностью растворения металлов в воде является то, что для некоторых металлов процесс растворения может быть спонтанным и экзотермическим, тогда как для других металлов он может быть эндотермическим и требовать постоянного поступления энергии для протекания реакции.
Итак, реакция растворения металлов в воде и образование солей являются важной частью химических процессов. Они позволяют получать различные продукты, которые находят широкое применение в различных отраслях промышленности и повседневной жизни.
Вода как среда для окислительно-восстановительных реакций
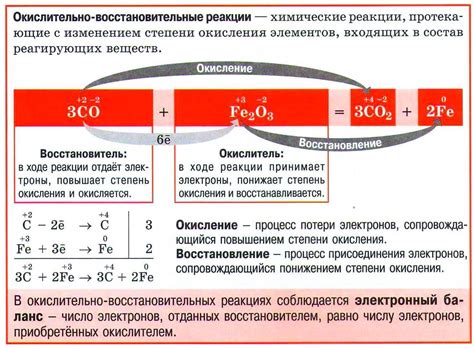
Вода является одной из наиболее распространенных и важных сред для окислительно-восстановительных реакций. Это связано с ее уникальными свойствами и химической структурой.
Вода обладает способностью как окисляться, так и восстанавливаться. Это означает, что вода может участвовать в реакциях, в ходе которых одна вещество теряет электроны (восстановление), а другое вещество приобретает электроны (окисление). Эти реакции происходят в присутствии различных металлов.
Взаимодействие воды с металлами является классическим примером окислительно-восстановительных реакций. Металлы могут реагировать с водой, образуя гидроксиды и выделяя водород. Это происходит благодаря тому, что вода действует как окислительное вещество и принимает электроны от металла.
Вода также может быть восстановлена металлам. Например, некоторые металлы, такие как железо, реагируют с водой, образуя гидроксид и выделяя водород. В данном случае вода действует как восстановительное вещество и отдает свои электроны металлу.
Важно отметить, что реакция воды с металлами зависит от их активности. Некоторые металлы, такие как натрий или калий, очень активны и реагируют с водой даже в холодной ее форме, при этом образуя щелочи и выделяя горючий водород. Другие металлы, такие как алюминий или цинк, реагируют с водой только при нагревании или в присутствии катализаторов.
Таким образом, реакция воды с металлами является особым видом окислительно-восстановительных реакций, которые происходят в нашей повседневной жизни и имеют важное значение в различных областях науки и технологии.
Вопрос-ответ

Как происходит реакция воды с металлами?
Реакция воды с металлами протекает по следующему механизму: металл вступает в химическую реакцию с водой, в результате чего образуется гидроксид металла и выделяется водород.
Каковы особенности реакции воды с металлами?
Особенности реакции воды с металлами заключаются в том, что она может проходить только с активными металлами, такими как натрий, калий, магний, алюминий и т.д. Кроме того, скорость реакции может зависеть от различных факторов, таких как температура и концентрация воды.
