Химические реакции металлов являются основой многих процессов в нашей жизни. Металлы имеют способность вступать в химические реакции с различными веществами, такими как кислород, вода и кислоты. В результате этих реакций образуются разнообразные продукты, которые могут быть как полезными, так и вредными.
Одним из примеров химической реакции металлов является окисление железа. При контакте железа с кислородом из воздуха происходит химическая реакция, в результате которой образуется ржавчина. Эта реакция называется окислительным процессом и является примером коррозии металлов.
Другим примером химической реакции металлов является реакция золота с цианидом. Золото обладает высокой стойкостью к большинству химических веществ, но при взаимодействии с цианидом происходит химическая реакция, в результате которой образуется растворимое соединение золота. Эта реакция используется в процессе извлечения золота из руды.
Химические реакции металлов имеют большое значение в научных и промышленных сферах. Они позволяют получить новые материалы, а также осуществлять различные процессы, такие как производство металлов и их сплавов, электролиз и другие.
Важно отметить, что химические реакции металлов могут быть не только полезными, но и опасными. Например, реакция алюминия с кислотой сопровождается выделением взрывоопасного водорода. Поэтому, при работе с металлами необходимо соблюдать меры безопасности и выполнять соответствующие условия и требования.
Взаимодействие металлов с кислородом

Взаимодействие металлов с кислородом является одной из основных химических реакций, которая имеет широкую практическую значимость. В процессе этой реакции металлы окисляются, образуя оксиды, которые являются основной формой соединения металла с кислородом.
Окисление металлов происходит вследствие их активности, то есть способности активно взаимодействовать с кислородом. Некоторые металлы, такие как натрий или калий, обладают высокой активностью и могут гореть на воздухе с ярким пламенем.
Реакция окисления металлов с кислородом может протекать с разной интенсивностью. Некоторые металлы, например, алюминий или магний, образуют пассивные пленки оксидов на поверхности, которые не пропускают кислород и защищают металл от дальнейшего окисления.
Окисление металлов с кислородом широко применяется в различных отраслях промышленности. Например, при производстве стали, металлы подвергаются окислению, что позволяет улучшить их качество и свойства. Также, реакция окисления металлов используется при получении электроэнергии в гальванических элементах.
В заключение, взаимодействие металлов с кислородом является важной химической реакцией, которая имеет множество практических применений. Окисление металлов с кислородом приводит к образованию оксидов, которые могут быть использованы в разных областях промышленности и технологии.
Окисление металлов

Окисление металлов - это процесс, при котором металл вступает в химическую реакцию с кислородом или другими окислителями. В результате этой реакции металл теряет электроны и образует окисленные соединения.
Окисление металлов может происходить как в атмосфере, где кислород является основным окислителем, так и в растворах, где металл может реагировать с различными кислотами или щелочами. Характер реакции зависит от реакционной способности металла и условий окружающей среды.
В результате окисления металлов образуются различные окислы. Например, окисление железа приводит к образованию ржавчины или железного оксида. Окисление алюминия приводит к образованию оксида алюминия, который формирует защитную пленку на поверхности металла и предотвращает дальнейшее окисление.
Окисление металлов может приводить к разрушению их структуры и свойств. Например, при окислении железа в результате ржавления, металл теряет прочность и устойчивость к коррозии. Поэтому важно предпринимать меры для защиты металлов от окисления, например, путем покрытия их защитными покрытиями или применения антиоксидантов.
Формирование оксидов
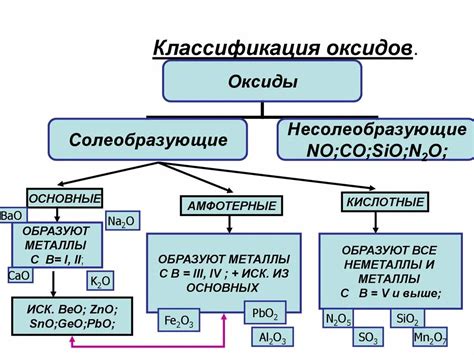
Одной из типичных химических реакций металлов является их взаимодействие с кислородом, в результате которого образуются оксиды металлов. Оксиды – это соединения металлов с кислородом.
Процесс формирования оксидов металлов может происходить различными путями. Например, металлы могут реагировать с кислородом воздуха при нагревании или при контакте с кислородсодержащими веществами. Реакция между металлом и кислородом протекает с выделением энергии в виде тепла и света.
Возможные результаты реакции металлов с кислородом могут быть разнообразными. Некоторые металлы образуют простые оксиды, в которых кислород связан с металлом одним соединительным атомом. Другие металлы могут образовывать сложные оксиды, в которых кислород связан с металлом несколькими атомами или ионами.
Оксиды металлов имеют различные свойства и применяются в разных областях. Некоторые оксиды металлов являются основными, то есть они обладают щелочными свойствами и могут нейтрализовать кислоты. Другие оксиды являются кислотными и могут образовывать кислотные растворы при контакте с водой. Также имеются нейтральные оксиды, которые не обладают доступными для реакций свойствами.
Взаимодействие металлов с водой

Вода является одной из сильнейших окислительных сред, поэтому не все металлы способны взаимодействовать с ней. Реакция металлов с водой может протекать различными способами, в зависимости от свойств металла и условий реакции.
Активные металлы, такие как натрий, калий и литий, реагируют с водой быстро и интенсивно. Они образуют гидроксиды металлов (щелочи) и высвобождаются водород. Реакция происходит с выделением большого количества тепла и сопровождается характерными всплесками и пузырьками газа.
Менее активные металлы, например магний и цинк, также реагируют с водой, но гораздо медленнее. При взаимодействии с водой они образуют гидроксиды, однако выделение водорода происходит в меньшем количестве и температура реакции не так высока.
Большинство неметаллов не реагируют с водой. Они не способны отдавать электроны и образовывать гидроксиды. Исключением является фосфор, который при нагревании с водой образует фосфорную кислоту и выделяет горючий газ фосфороводород.
Реакции металлов с водой имеют важное практическое значение. Например, взаимодействие активных металлов с водой используется для получения водорода в лаборатории, а также в промышленности. Знание свойств и реакций металлов с водой позволяет эффективно использовать их в различных областях науки и техники.
Образование гидроксидов
Гидроксиды - это соединения, состоящие из металла и гидроксильной группы, представленной атомом кислорода и атомом водорода. Они образуются в результате химических реакций металлов с водой или растворами щелочей.
Гидроксиды широко распространены в природе и имеют важное промышленное и хозяйственное значение. Они используются, например, в процессе производства щелочей, растворителей, катализаторов и ряда других веществ.
Образование гидроксидов начинается с реакции металла с водой. Некоторые металлы, такие как натрий и калий, реагируют с водой быстро и ярко. При этом образуются соответствующие гидроксиды и выделяется водород. Реакция натрия с водой можно представить следующим уравнением:
| Реагенты | Продукты |
|---|---|
| 2Na + 2H2O | 2NaOH + H2 |
Другие металлы, такие как железо или алюминий, не реагируют с водой, но могут растворяться в растворах щелочей, образуя соответствующие гидроксиды. К примеру, растворение железа в щелочи можно описать следующим уравнением:
| Реагенты | Продукты |
|---|---|
| Fe + 2NaOH | Na2FeO2 + H2O |
Таким образом, образование гидроксидов представляет собой важный процесс, наиболее характерный для реакций металлов с водой и растворами щелочей.
Выделение водорода
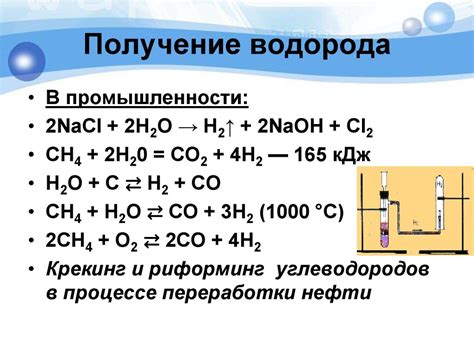
Выделение водорода (H2) – одна из важнейших реакций, связанных с металлами. Реакция происходит при взаимодействии активного металла с водой или кислотой. При этом выделяется водородный газ, который можно использовать в различных сферах.
Первый способ выделения водорода – взаимодействие металла с водой. Например, натрий (Na) реагирует с водой по следующему уравнению: 2Na + 2H2O → 2NaOH + H2. При этом образуется гидроксид натрия (NaOH) и выделяется водородный газ. Эта реакция является сильно экзотермической и сопровождается высвобождением большого количества тепла.
Второй способ выделения водорода – взаимодействие металла с кислотой. Например, цинк (Zn) реагирует с соляной кислотой по следующему уравнению: Zn + 2HCl → ZnCl2 + H2. В результате образуется хлорид цинка (ZnCl2) и выделяется водородный газ. При этом важно помнить, что реакция металлов с кислотами происходит с выделением водорода, который является горючим, поэтому с такими веществами необходимо быть осторожными и соблюдать все меры предосторожности.
Выделение водорода имеет важное применение в различных областях, таких как производство энергии, промышленность, химия и многие другие. Водородный газ широко используется в качестве источника энергии, так как он горюч и при сгорании не выделяет вредных веществ. Также водород используется в процессе создания различных химических соединений, водородных брендов и водородных топливных элементов.
Взаимодействие металлов с кислотами

Металлы могут реагировать с кислотами, образуя соли и выделяя водородный газ. Эта реакция является одной из основных химических реакций металлов.
В зависимости от активности металлов, их взаимодействие с кислотами может проходить по-разному. Активные металлы, такие как натрий или калий, могут реагировать с кислотами даже при комнатной температуре. Это связано с высокой реакционной способностью таких металлов.
Реакция металлов с кислотами приводит к образованию солей. Например, взаимодействие натрия с соляной кислотой приводит к образованию хлорида натрия и выделению водорода:
2Na + 2HCl → 2NaCl + H2
При реакции металл с кислотой высвобождается водородный газ. Это можно наблюдать появлением пузырьков газа на поверхности металла. Возникший водородный газ часто возгоняют или собирают в специальных устройствах.
Реакция металлов с кислотами имеет практическое применение. Например, с помощью этой реакции можно проводить анализ содержания металлов в различных образцах. Кроме того, эта реакция может служить источником водорода, который используется в различных химических процессах и энергетике.
Образование солей
Соли - это химические соединения, состоящие из металла и неметалла. Образование солей описывается реакцией между кислотой и основанием или между металлом и кислотой.
Реакция между кислотой и основанием называется нейтрализацией. В результате этой реакции образуется соль и вода. Кислота отдает свой протон (водородный ион) основанию, при этом основание отдает свою гидроксильную группу кислоте. Это приводит к образованию соли и воды. Например, реакция между соляной кислотой (HCl) и гидроксидом натрия (NaOH) дает соль натрия и воду:
HCl + NaOH → NaCl + H2O
Реакция между металлом и кислотой приводит к образованию соответствующей соли металла и водорода. Металл отдает свои электроны кислоте, при этом кислота отдает свой протон металлу. Реакция происходит с образованием соли и водорода. Например, реакция между цинком (Zn) и соляной кислотой (HCl) дает хлорид цинка (ZnCl2) и водород:
Zn + 2HCl → ZnCl2 + H2
Образование солей является одной из важных реакций металлов, которые играют важную роль в химии и промышленности. Соли имеют широкий спектр применений, они используются в производстве удобрений, красителей, пищевых добавок, лекарств и многих других продуктов.
Вопрос-ответ

Какие есть примеры химических реакций металлов?
Примеры химических реакций металлов включают реакцию железа с кислородом, называемую окислением. Реакция представляет собой образование ржавчины (оксида железа). Еще один пример - реакция цинка с серной кислотой, где образуется сульфат цинка и выделяется водородный газ.
Как происходит реакция меди с азотной кислотой?
Реакция меди с азотной кислотой приводит к образованию нитрат меди и окисления меди. В результате медь становится покрытой кислотным оксидом.
Что происходит при реакции свинца с соляной кислотой?
Реакция свинца с соляной кислотой приводит к образованию хлорида свинца и выделению водородного газа. При этой реакции происходит растворение свинца и выделение газа.
Какую реакцию проходит алюминий с гидроксидом натрия?
Алюминий с гидроксидом натрия проходит реакцию образования алюминиягидроксида и выделения водорода. Эта реакция идет с образованием зеленого осадка гидроксида алюминия.
