Соли щелочных металлов - это соединения, образованные из ионов щелочных металлов (лития, натрия, калия, рубидия и цезия) и анионов. Формулы этих солей имеют определенную структуру и позволяют определить состав и свойства соединений. Они широко используются в различных областях, включая химическую промышленность, медицину и науку.
Примером соли щелочного металла является хлорид натрия, обычно известный как поваренная соль. Его формула NaCl указывает на то, что соль состоит из одного иона натрия (Na+) и одного иона хлора (Cl-). Этот тип солей обычно обладает высокой степенью растворимости в воде и широко используется в пищевой промышленности и бытовой химии.
Карбонат натрия (Na2CO3) - еще один пример соли щелочного металла. Его формула указывает на наличие двух ионов натрия (Na+) и одного иона карбоната (CO32-). Карбонат натрия используется в промышленности для производства стекла, моющих средств и водоочистки. Он также используется в бытовых условиях для очистки от засорения и отбеливания.
Химический состав солей щелочных металлов
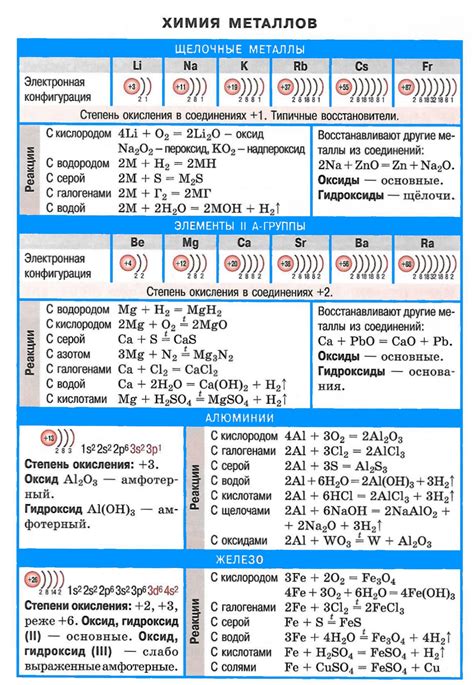
Соли щелочных металлов представляют собой химические соединения, состоящие из щелочного металла и негативно заряженного иона. Щелочные металлы включают литий, натрий, калий, рубидий, цезий и франций.
Одна из самых простых формул солей щелочных металлов - это формула хлорида натрия (NaCl), который является одним из наиболее распространенных соединений этой группы. Другие примеры включают сульфаты (например, сульфат калия - K2SO4) и карбонаты (например, карбонат лития - Li2CO3).
Соли щелочных металлов широко используются в различных областях. Например, хлорид натрия используется в пищевой промышленности для придания вкуса и консервации продуктов. Карбонат калия используется в производстве стекла и мыла. Сульфат калия используется в сельском хозяйстве как удобрение.
Структура солей щелочных металлов обычно кристаллическая, с регулярно расположенными ионами. Эти соли могут быть в виде кристаллов, порошков или растворов. Их свойства и реакционная способность определяются их химическим составом и организацией внутренней структуры.
Соли лития: формулы и свойства
Литий - это элемент периодической системы, принадлежащий к группе щелочных металлов. Он обладает атомным номером 3 и химическим символом Li. Свою название он получил от греческого слова "lithos", что означает камень, так как он обнаружен в минералах.
Соли лития образуются в результате реакции его сильнокислых оксидов Li2O с кислотами. Важной особенностью солей лития является то, что они обладают малой растворимостью в воде, особенно хорошо видно на примере хлорида LiCl и нитрата LiNO3. Это свойство легко объяснить высокой сродствностью ионов Li+ к воде. При этом соли лития обладают высокой электропроводностью в расплавленом состоянии или в составе растворов.
Наиболее распространенные соли лития включают в себя литиевые карбонат и литиевые гидроксид. Формула литиевого карбоната Li2CO3, а формула литиевого гидроксида LiOH. Оба этих соединения являются белыми кристаллическими веществами и широко используются в фармацевтической промышленности, производстве стекла, литий-ионных аккумуляторов и других сферах.
Соли лития используются также в медицине в качестве препаратов для лечения психических расстройств, таких как биполярное расстройство. Кроме того, упомянутые свойства солей лития позволяют им использоваться в качестве теплоносителя, например, в низкотемпературных ядерных реакторах.
Натриевые соли: структура и реакции
Натриевые соли, соединения натрия с различными кислотами, имеют разнообразную структуру и проявляют уникальные химические свойства. В основном они представляют собой кристаллические соединения, образующие регулярные кристаллические решетки.
К примеру, натрия гидроксид (NaOH) является одной из самых распространенных натриевых солей и обладает структурой, состоящей из ионов натрия (Na+) внутри кубической элементарной ячейки, окруженной ионами гидроксидного (OH-) радикала. Такая структура позволяет гидроксиду натрия обладать щелочными свойствами и использоваться в различных областях, включая промышленность, бытовую химию и медицину.
Натриевые соли также проявляют реактивность при взаимодействии с другими веществами. Например, растворение натриевых солей в воде приводит к образованию ионов натрия и соответствующих ионов кислоты или основания. Натриевые соли сильных кислот могут иногда действовать как кислоту обладающие физиологическим действием – проводимости. В свою очередь, натриевые соли слабых кислот могут выступать в роли оснований, проявляя реакцию обмена и образуя соли других металлов.
В итоге, натриевые соли являются важными соединениями, нашедшими применение в самых различных областях. Их структура обуславливает их специфические свойства, а их реакции дают возможность использовать их в различных химических процессах и приготовлении различных продуктов.
Калиевые соли: виды и применение

Калий - это щелочной металл, который широко используется в различных сферах промышленности и научных исследований. У него есть несколько видов солей, которые отличаются своими химическими формулами и свойствами.
Калий хлорид (KCl) - это одна из наиболее распространенных калиевых солей. Она широко используется в пищевой промышленности в качестве добавки для придания соленого вкуса различным продуктам. Кроме того, калий хлорид используется в медицине в качестве диетического средства для пациентов с низким уровнем калия в организме.
Калий карбонат (K2CO3) - это еще одна распространенная калиевая соль. Она используется в производстве стекла, мыла, тонеров для копировальных аппаратов и других химических веществ. Калий карбонат также используется в медицине в качестве источника калия для лечения низкого калия в организме.
Калий сульфат (K2SO4) - это еще один вид калиевых солей. Он широко используется в сельском хозяйстве в качестве удобрения для повышения урожайности различных культур. Калий сульфат также используется в производстве стекла, мыла, шампуней и других химических веществ.
Калиевые соли имеют широкий спектр применения и являются важными веществами в различных отраслях науки и промышленности. Они не только используются в производстве различных продуктов, но и являются важными компонентами в медицине и сельском хозяйстве.
Соли рубидия и цезия: основные характеристики

Соли рубидия и цезия – это соединения, образованные ионами данных металлов и отрицательными ионами других элементов. Рубидий (Rb) и цезий (Cs) принадлежат к группе щелочных металлов, представленной в первой группе периодической системы элементов.
Особенностью солей рубидия и цезия является то, что они обладают существенно большими ионными радиусами по сравнению с другими щелочными металлами, такими как натрий или калий. Из-за этого, соли рубидия и цезия обладают рядом специфических свойств и характеристик.
Например, соли рубидия и цезия обладают пониженным температурным плавлением, что делает их использование в различных технологических процессах более удобным и эффективным. Кроме того, при некоторых условиях, соли рубидия и цезия могут образовывать легко плавящиеся оксоанионы, улучшающие стабильность и возможности использования этих соединений.
В связи с высокой реактивностью рубидия и цезия, их соли могут использоваться в различных областях, таких как электроника, оптика, фотоиндустрия и даже в медицине. Например, соли рубидия и цезия могут применяться в разработке электронных приборов, солнечных батарей и детекторов радиации.
Таким образом, соли рубидия и цезия являются важными соединениями в современной науке и технологии, обладающими уникальными свойствами и широким спектром применения.
Вопрос-ответ

Какие бывают соли щелочных металлов?
Соли щелочных металлов могут быть различными, в зависимости от того, какие кислоты вступают в реакцию с щелочными металлами. Например, существуют соли натрия, калия, лития и других щелочных металлов.
Какие формулы у солей щелочных металлов?
Формулы солей щелочных металлов можно записать в общем виде MX, где M обозначает щелочной металл (например, Na, K, Li), а X - отрицательный радикал кислоты, с которой взаимодействует металл.
Какие примеры формул солей щелочных металлов?
Примеры формул солей щелочных металлов: NaCl (хлорид натрия), K2SO4 (сульфат калия), LiNO3 (нитрат лития), и так далее. Конкретные формулы зависят от кислоты, с которой реагирует щелочной металл.
Как записывать формулы солей щелочных металлов?
Формулы солей щелочных металлов записываются с учетом заряда и валентности металла и отрицательного радикала кислоты. Например, при записи формулы KCl (хлорид калия), заряд K равен 1+, а Cl равен 1-. В случае LiNO3 (нитрат лития), заряд Li равен 1+, а NO3 равно 1-.
Какие свойства имеют соли щелочных металлов?
Соли щелочных металлов обладают рядом характерных свойств. Они обычно хорошо растворимы в воде и образуют бесцветные или белые кристаллы. Они также могут иметь высокую теплопроводность и теплоемкость. Соли щелочных металлов используются в различных областях, включая производство стекла, синтез химических соединений и др.
