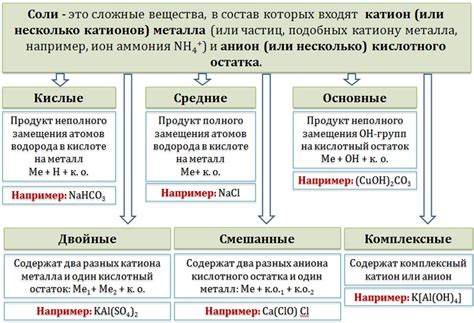
Реакции солей металлов - это химические процессы, при которых происходит образование новых веществ. Данный пример демонстрирует реакцию между раствором соли металла и раствором другого соединения. Такая реакция часто используется в лабораторных исследованиях и промышленности для получения ценных продуктов.
Представим, что у нас имеется раствор соли меди (CuSO4), который мы хотим прокатить через раствор алюминия (Al). В процессе реакции происходит образование новых соединений и выделение продукта.
Al + CuSO4 → Al2(SO4)3 + Cu
В приведенном примере металл алюминий замещает металл медь в соли CuSO4. В результате образуется новая соль Al2(SO4)3 и отделяется металл медь (Cu).
Подобные реакции часто используются для получения металлов и соединений в промышленных масштабах. Они являются важным инструментом в химических исследованиях и могут быть использованы для получения различных продуктов.
Пример уравнения реакции соли металлов
Реакции солей металлов являются одним из основных типов химических реакций. Соли металлов обычно состоят из катиона металла и аниона. Уравнение реакции соли металла показывает, как происходит обмен ионами вещества.
Примем, например, реакцию между хлоридом натрия (NaCl) и серной кислотой (H2SO4). При смешении этих двух веществ образуются новые вещества - хлороводород (HCl) и сульфат натрия (Na2SO4).
Уравнение реакции можно записать следующим образом:
- NaCl + H2SO4 → Na2SO4 + HCl
В данном случае, натрий (Na) из хлорида натрия (NaCl) замещает водород (H) в серной кислоте (H2SO4), образуя сульфат натрия (Na2SO4) и хлороводород (HCl).
Таким образом, уравнение реакции соли металла позволяет показать структуру ионов вещества и изменения, которые происходят в результате химической реакции. Они имеют широкое применение в различных областях, таких как промышленность, медицина и наука.
Определение и общий принцип

Определение: Уравнение реакции соли металлов представляет собой химическую реакцию, в которой соль металла взаимодействует с реагентом или другой солью для образования новых веществ.
Общий принцип уравнения реакции соли металлов состоит в том, что ионы металла в соли реагируют с ионами другого реагента или соли для образования новых соединений. Реакция может протекать как в растворе, так и в твердом состоянии, в зависимости от условий.
Основными шагами при написании уравнения реакции соли металлов являются:
- Определение ионов, присутствующих в соли металла.
- Определение ионов, присутствующих в другом реагенте или соли.
- Определение соединений, которые образуются в результате реакции.
- Написание уравнения реакции, учитывая баланс ионов и атомов.
Например, уравнение реакции между хлоридом натрия и серной кислотой можно записать следующим образом:
NaCl + H2SO4 -> NaHSO4 + HCl
В этом уравнении ионы натрия и хлора из хлорида натрия реагируют с ионами серы и водорода из серной кислоты для образования сульфата натрия и хлороводорода.
Ключевые факторы в уравнении реакции

Уравнение реакции является основным инструментом в химии, позволяющим описать химическую реакцию в виде соотношения между реагентами и продуктами. При решении задач по уравнению реакции необходимо учитывать ряд ключевых факторов, которые могут влиять на процесс и его результат.
Вид реакции: Один из основных факторов, который следует учитывать при уравнении реакции, это вид самой реакции. В зависимости от типа реакции (окислительно-восстановительная, кислотно-щелочная, простое замещение и т.д.) будут выбираться соответствующие реагенты и продукты.
Балансировка: Другим ключевым фактором является балансировка уравнения реакции. Балансировка предполагает установление правильного соотношения между количеством атомов каждого элемента в реагентах и продуктах. Для этого необходимо использовать коэффициенты перед соответствующими формулами.
Термодинамические условия: Уравнение реакции также может зависеть от термодинамических условий, таких как давление, температура и концентрация. В некоторых случаях реакции могут проходить только при определенных давлении и температуре, а концентрация реагентов может влиять на скорость реакции.
Порядок реакции: Кроме того, порядок реакции, то есть последовательность, в которой протекают отдельные стадии реакции, может также влиять на уравнение. Например, если реакция является сложной и включает несколько этапов, то уравнение может быть представлено в виде нескольких ступеней.
Катализаторы: Иногда в уравнение реакции добавляются катализаторы - вещества, которые ускоряют химическую реакцию, но при этом не участвуют в самом процессе. В таком случае необходимо учесть наличие катализаторов и их влияние на уравнение.
Все эти факторы являются важными при уравнении реакции и требуют внимательного изучения и анализа. Они помогают представить процесс химической реакции в виде точной и связанной системы, позволяя получить более полное представление о происходящих изменениях и взаимосвязях.
Шаги решения уравнения

Для решения уравнения реакции соли металлов, вам потребуется выполнить несколько шагов:
- Определите ионы в соли: рассмотрите формулу соли и определите, какие ионы входят в ее состав. Например, в соли меди(II) хлорида (CuCl2), ионы меди (Cu2+) и ионы хлора (Cl-) будут присутствовать.
- Найдите ионы, которые могут образовать соединения с другими элементами: посмотрите на значения зарядов ионов и определите, какие из них могут образовывать соединения с другими элементами. Например, ионы меди (II) могут образовывать соединения с ионами кислорода (O2-) или серы (S2-).
- Составьте уравнение реакции: используя найденные ионы и заряды, составьте уравнение реакции. Например, если ионы меди (II) реагируют с ионами кислорода, уравнение может выглядеть следующим образом: 2Cu2+ + O2- → 2CuO.
- Сбалансируйте уравнение: проверьте, чтобы количество атомов каждого элемента было одинаковым на обеих сторонах уравнения. Если это не так, добавьте коэффициенты перед соответствующими формулами веществ, чтобы сбалансировать уравнение. Например, если в уравнении выше имеется несбалансированное количество атомов меди, можно добавить коэффициент 2 перед формулой CuO, чтобы получить сбалансированное уравнение: 2Cu2+ + O2- → 2CuO.
Эти шаги помогут вам решить уравнение реакции соли металлов и написать сбалансированное уравнение, которое описывает происходящую химическую реакцию.
Пример практического решения

Представим ситуацию, в которой нам необходимо найти уравнения реакции соли металлов. Рассмотрим конкретный пример: растворение меди в серной кислоте.
Сначала необходимо записать формулу реагирующих веществ: Cu + H2SO4. Предполагая, что реакция протекает в водной среде, можно записать ионные формулы для меди и серной кислоты: Cu + 2H+ + SO42-.
Далее, чтобы соблюсти закон сохранения массы и заряда, следует уравнять уравнение реакции по количеству атомов веществ в стартовом и конечном состоянии. С учетом того, что одна медная молекула реагирует с двумя ионами водорода и одним ионом серы, можно записать окончательное уравнение реакции: Cu + 2H+ + SO42- → Cu2+ + SO2 + 2H2O.
Здесь стоит отметить, что соли металлов растворяются в воде с образованием соответствующих ионов и молекул. В данном случае, медная соль CuSO4 диссоциирует на ионы меди (Cu2+) и серы (SO42-).
Таким образом, приведенный пример демонстрирует практическое решение уравнения реакции соли металла на основе теоретических знаний об ионах и массах веществ. Умение корректно записывать и уравнивать реакции солей металлов позволяет нам анализировать и понимать процессы, происходящие при их растворении и взаимодействии с другими веществами.
Выводы и применение

Познакомившись с практическим примером уравнения реакции соли металлов, мы можем сделать несколько выводов. Во-первых, реакции солей металлов протекают в соответствии с определенными закономерностями и уравнениями. Это позволяет нам предсказывать результаты таких реакций и использовать их в различных практических сферах.
Во-вторых, уравнение реакции соли металла позволяет нам определить, какие вещества будут образовываться в результате реакции и в каких пропорциях. Это важно, например, при производстве различных материалов и соединений, где точность и предсказуемость реакции являются критическими факторами.
Также, знание уравнения реакции соли металла позволяет нам использовать это уравнение в качестве рабочего инструмента для расчетов и прогнозирования реакций. Например, это может быть полезно при проектировании химических процессов или при проведении химического анализа веществ.
Выводы и применение практического примера уравнения реакции соли металлов полезны в нашей повседневной жизни и научной деятельности. Они помогают нам понять механизмы химических реакций и использовать их для достижения конкретных целей и задач.
Вопрос-ответ

Какое уравнение реакции будет при взаимодействии металла натрия и хлорида натрия?
Уравнение реакции будет выглядеть следующим образом: 2Na + Cl2 -> 2NaCl, где Na обозначает металл натрий, Cl2 - молекулы хлора, а NaCl - хлорид натрия.
Что произойдет, если металл алюминий прореагирует с хлоридом алюминия?
При реакции алюминия и хлорида алюминия образуется соединение AlCl3, с указанием коэффициента 2Al + 3Cl2 -> 2AlCl3. Таким образом, на каждые 2 атома алюминия требуется 3 молекулы хлора.
Как можно представить уравнение реакции между цинком и сульфатом цинка?
Уравнение реакции будет иметь вид: Zn + ZnSO4 -> Zn2SO4, где Zn обозначает металл цинк, ZnSO4 - сульфат цинка, а Zn2SO4 обозначает соединение, образовавшееся в результате реакции.
Что произойдет, если алюминий взаимодействует с нитратом алюминия?
При реакции алюминия и нитрата алюминия образуется соединение Al(NO3)3, с учетом коэффициента 2Al + 3(NO3)2 -> 2Al(NO3)3.
Какой будет уравнение реакции при взаимодействии меди и хлорида меди?
Уравнение реакции будет иметь вид: 2Cu + 2Cl -> 2CuCl, где Cu обозначает медь, а CuCl - хлорид меди.
