Электрохимическая коррозия является одной из основных проблем, с которыми сталкиваются металлические конструкции и изделия. Этот процесс происходит под влиянием окружающей среды и может привести к разрушению металла. Одним из наиболее известных примеров электрохимической коррозии является ржавчина, которая поражает железо и сталь. Но не только железо подвержено этому процессу, коррозия может повредить множество других металлов, включая алюминий, цинк, медь и другие.
Существуют несколько этапов электрохимической коррозии, начиная с анодного процесса, где происходит окисление металла. Под влиянием окружающей среды, такой как вода или воздух, некоторые электрохимические реакции происходят на поверхности металла. Это приводит к тому, что металл окисляется, а его электроны перемещаются на катод, где происходит восстановление металла. В итоге это приводит к разрушению металлической структуры и образованию продуктов коррозии, таких как ржавчина.
Однако существуют способы предотвратить или замедлить процесс электрохимической коррозии. Один из них - использование защитных покрытий на поверхности металла, таких как краска или полимерные пленки. Это помогает предотвратить контакт металла с вредными веществами, которые могут вызвать коррозию. Также существуют специальные подкладки из антикоррозийных материалов, которые могут быть установлены между металлическими поверхностями для предотвращения электрохимической реакции. Кроме того, можно применить методы катодной защиты, основанные на применении внешних источников тока, чтобы подавить анодные процессы коррозии.
Электрохимическая коррозия металла: пример и предотвращение
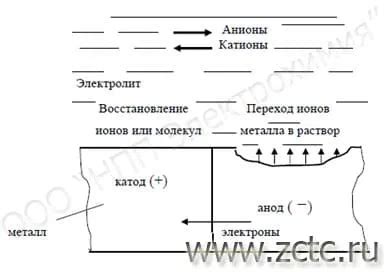
Электрохимическая коррозия - это процесс разрушения металла под влиянием химических реакций с окружающей средой. Один из примеров такой коррозии - образование ржавчины на поверхности железа. В данном случае происходит окисление железа в присутствии кислорода из воздуха и воды.
Для предотвращения электрохимической коррозии металла можно использовать несколько методов. Во-первых, можно нанести на поверхность металла защитное покрытие, например, краску или лак. Такое покрытие создаст барьер между металлом и окружающей средой, предотвращая контакт с веществами, способными вызвать коррозию.
Во-вторых, можно применить метод катодной защиты, который основан на подключении к металлу второго, более активного металла, такого как алюминий или магний. Этот второй металл будет служить "жертвенным анодом", привлекая к себе реакции окисления и замедляя процесс коррозии основного металла.
Еще одним способом предотвратить электрохимическую коррозию металла является использование антикоррозионных добавок, например, специальных противокоррозионных покрытий или добавок к растворам, в которые погружен металл. Эти добавки могут образовывать защитную пленку на поверхности металла, которая мешает проникновению вредных веществ.
В итоге, выбор метода предотвращения электрохимической коррозии металла зависит от конкретных условий эксплуатации и материала металла. Важно помнить о необходимости регулярного обслуживания и проверки состояния защитных покрытий или других средств предотвращения коррозии, чтобы своевременно их обновлять или заменять при необходимости.
Как происходит электрохимическая коррозия металла
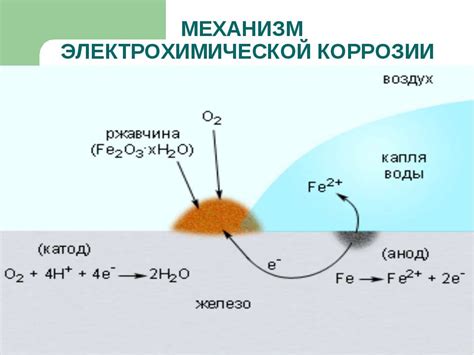
Электрохимическая коррозия металла - это процесс, при котором металл подвергается разрушению под воздействием химических реакций, вызванных взаимодействием металла с окружающей средой. Этот процесс основан на преобразовании химической энергии в электрическую и обратно.
Электрохимическая коррозия связана с наличием электролита (жидкой или влажной среды), который служит проводником для электрического тока. Когда металл погружается в электролит, он становится анодом, а вода или иные вещества становятся катодами. Между анодом и катодами возникает разность потенциалов, что приводит к течению электрического тока, а следовательно, к химическим реакциям, в результате которых металл начинает разрушаться.
В процессе электрохимической коррозии металла происходят две основные реакции - окисление и восстановление. При окислении на металле образуются ионы металла, которые высвобождаются в электролит. Восстановление происходит на катоде, где ионы металла возвращаются в свою исходную форму.
Для профилактики электрохимической коррозии металла важно применять защитные меры. Одним из способов предотвращения коррозии является применение покрытий, например, покрытий из цинка или кадмия, которые служат жертвенным анодом и защищают основной металл от коррозии. Также можно использовать методы активной и пассивной защиты, включая анодную защиту и использование защитных покрытий, состоящих из оксидов или нитридов металлов.
Методы предотвращения электрохимической коррозии металла
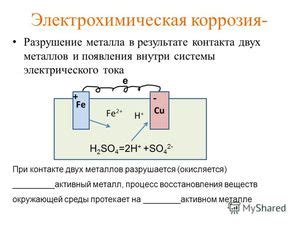
Для предотвращения электрохимической коррозии металла существует несколько эффективных методов, которые могут быть применены в различных условиях и ситуациях.
Первым методом является использование защитных покрытий. Это может быть нанесение на металлическую поверхность слоя защитных покрытий, таких как краска, эмаль или пластик. Эти покрытия создают барьер между металлом и окружающей средой, предотвращая контакт с агрессивными веществами и уменьшая риск коррозии.
Второй метод предотвращения коррозии - использование протекторов и антикоррозионных покрытий. Протекторы – это анодные приборы, которые размещаются на металлической поверхности и принимают на себя все агрессивное воздействие окружающей среды. Они создают особую электрохимическую среду на поверхности металла, благодаря которой развитие коррозии замедляется или полностью прекращается.
Третий метод - использование катодной защиты. Этот метод основан на создании катода из более активного металла, который будет жертвовать собственными электронами во время реакции коррозии. Катод образуется на металлической поверхности и предотвращает коррозию основного металла за счет электрохимического процесса.
Четвертый метод предотвращения коррозии - использование качественных материалов. Выбор правильного металла или сплава в зависимости от условий эксплуатации может значительно уменьшить риск возникновения электрохимической коррозии. Например, использование нержавеющей стали, которая обладает высокой стойкостью к коррозии, может быть хорошим вариантом для металлических конструкций, находящихся в агрессивных средах.
В зависимости от конкретных условий эксплуатации и требований, могут использоваться различные комбинации этих методов, а также еще более сложные технологии и методики. Однако, необходимо помнить, что предотвращение электрохимической коррозии металла требует комплексного подхода и постоянного внимания к состоянию и защите металлических поверхностей.
Вопрос-ответ

Что такое электрохимическая коррозия металла?
Электрохимическая коррозия металла - это процесс разрушения металла под воздействием окружающей среды. Она происходит из-за электрохимических реакций между металлическим материалом, оксидантами и электролитами. В результате этой реакции металл постепенно разрушается, что может привести к снижению его прочности и функциональных свойств.
Как происходит электрохимическая коррозия металла?
Процесс электрохимической коррозии металла состоит из трех основных стадий: анодной, катодной и переноса. В анодной области происходит окисление металла и образование металлических ионов, которые переносятся в окружающую среду. В катодной области происходит редукция окислителей, например кислорода из воздуха или воды. Ионный перенос происходит через электролит между анодом и катодом, что позволяет поддерживать непрерывный процесс коррозии.
