Электрохимическая коррозия металлов является одной из наиболее распространенных проблем в сфере материаловедения и инженерии. Коррозия может привести к серьезным повреждениям металлических конструкций, устройств и оборудования различного назначения. Относительная столь малая энергия, затрачиваемая на создание металлургического изделия, расстраивает пользователя, который столкнулся с проблемой похрустывания и разрушения на этапе эксплуатации. Описание процессов коррозии, особенно с учетом анодной реакции, позволяет обосновать выбор материала и разработать меры по защите и предотвращению коррозии.
Электрохимический процесс коррозии представляет собой побочный продукт химического реакции между металлом и окружающей средой. Когда металлическая поверхность подвергается воздействию агрессивных сред, образуется потенциал, создающий электрическую цепь между анодом и катодом. Проходит ток через коррозионную среду, вызывая окисление металла на аноде и снижая его массу. В присутствии воды или влаги, электрохимический процесс коррозии становится еще более активным и может привести к аккумулированию важных продуктов разрушения металла.
Механизм электрохимической коррозии металла на аноде включает в себя несколько этапов. В начале процесса, на поверхности металла происходит окисление, что приводит к образованию ионов металла и электронов. Электроны переносятся от металла к католу через электрическую цепь, а ионы металла перемещаются через коррозионную среду к аноду. На поверхности анода ионы металла реагируют с агрессивной средой, образуя оксиды или другие соединения, которые частично растворяются. Как результат, металл теряет массу и образуются продукты коррозии.
Влияние окружающей среды на электрохимическую коррозию

Окружающая среда имеет значительное влияние на процесс электрохимической коррозии металлов. Особенности состава и свойств окружающей среды могут приводить к активации или ингибиции коррозионного процесса. При этом некоторые факторы окружающей среды способствуют увеличению скорости коррозии, в то время как другие ее снижают.
Один из ключевых факторов, влияющих на электрохимическую коррозию, - это наличие в окружающей среде агрессивных веществ, таких как кислоты, щелочи или соли. Присутствие этих веществ может вызывать активацию коррозионных процессов и ускорение разрушения металлов. В частности, кислотная среда может разрушать защитные оксидные пленки на поверхности металла, что приводит к обнажению его и дальнейшей коррозии.
Другим фактором, влияющим на электрохимическую коррозию, является температура окружающей среды. При повышенных температурах скорость коррозии обычно увеличивается. Это объясняется тем, что повышенная температура активирует электрохимические процессы на поверхности металла, что в свою очередь ускоряет разрушение металлической структуры.
Кроме того, на электрохимическую коррозию может влиять и концентрация кислорода в окружающей среде. Высокая концентрация кислорода может способствовать активации коррозии, особенно в случаях, когда металл находится в процессе пассивации. Низкая концентрация кислорода, напротив, может замедлять коррозионный процесс.
Окислительно-восстановительные реакции при электрохимической коррозии

Электрохимическая коррозия металлов на аноде является процессом окисления, который происходит при взаимодействии металла с окружающей средой. Один из важных аспектов этого процесса – это окислительно-восстановительные реакции, которые происходят на поверхности металла.
Окисление – это процесс, при котором атомы металла теряют электроны и превращаются в ионы, которые распространяются в окружающую среду. Это происходит под действием окислителя – вещества, способного принимать электроны и восстанавливаться. Примерами окислителей могут служить кислород, вода или другие химические вещества на поверхности металла.
Восстановление – это обратный процесс окисления, при котором ионы окислителя превращаются обратно в неокисленное состояние путем принятия электронов от металла. Это происходит на катоде – месте, где идет восстановление. При этом на поверхности металла образуются молекулы воды, кислорода, гидроксида металла и других веществ.
Окислительно-восстановительные реакции при электрохимической коррозии происходят последовательно на поверхности металла. Металлический кристалл, будучи вместе с окружающей средой, образует электрическую цепь, где металл является анодом, а окружающая среда – катодом. Этот потенциал разности электрического заряда между анодом и катодом приводит к тому, что на поверхности металла начинают протекать окислительно-восстановительные реакции.
В результате окислительно-восстановительных реакций образуются разные соединения, такие как оксиды, гидроксиды, соли и другие. Присутствие этих соединений на поверхности металла способствует дальнейшему разрушению материала и прогрессированию коррозии.
Электродные реакции в процессе коррозии металлов на аноде
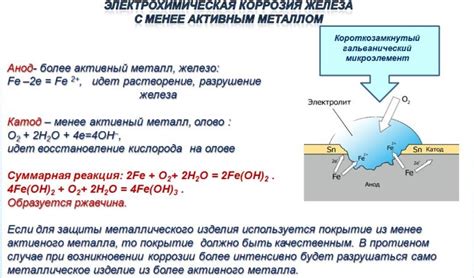
Электрохимическая коррозия металлов на аноде – это процесс, при котором металл под воздействием окружающей среды окисляется и выделяет электроны. В результате этого процесса образуются ионы металла, а на поверхности металла образуется слой оксида или других соединений.
Процесс коррозии металлов на аноде определяется электродными реакциями, которые происходят на поверхности металла. Время, необходимое для начала процесса коррозии, зависит от реакций на аноде и катоде, а также от свойств материала металла.
На анодной поверхности происходят окислительные реакции, в результате которых металл переходит в ионную форму. Это происходит за счет отрыва электронов от атомов металла. Основным процессом, приводящим к коррозии металла на аноде, является окисление. Отрыв электронов от атомов металла может происходить по разным механизмам и зависит от свойств металла и окружающей среды.
В результате окислительной реакции на аноде образуются ионы металла и электроны, которые переносятся через электролит к катоду. Именно электроны служат двигателем для проведения коррозионных процессов. Однако, электроны не могут двигаться в электролите без наличия в электролите других ионов.
Факторы, влияющие на скорость процесса электрохимической коррозии

Скорость процесса электрохимической коррозии металлов на аноде зависит от нескольких факторов, которые влияют на его интенсивность и характер. Они определяются как внутренними, так и внешними условиями, средой, а также свойствами самого металла.
1. Наличие агрессивных сред
Одним из важных факторов является химическая активность окружающей среды и ее воздействие на металл. Кислоты, щелочи, растворы солей, влажность и температура могут ускорять процесс коррозии. Например, агрессивные среды, такие как соляная кислота или серная кислота, могут вызывать разрушение металла на атомарном уровне.
2. Электрический потенциал
Разница электрических потенциалов между анодом и катодом также является важным фактором в процессе коррозии. Чем больше разница потенциалов, тем выше скорость коррозии. Например, если металл находится в контакте с более активным металлом, то он становится анодом и будет корродировать быстрее.
3. Температура
Температура также оказывает воздействие на скорость процесса коррозии. При повышении температуры реакционная активность в системе возрастает, что ускоряет электрохимическую коррозию. Особенно это характерно для агрессивных сред, в которых повышение температуры увеличивает скорость диффузии агрессивных ионов к металлической поверхности.
4. Содержание кислорода
Кислород является основной причиной коррозии железа и сталей. Высокое содержание кислорода в окружающей среде значительно ускоряет процесс коррозии. Кислород воздуха проникает через различные отверстия в покрытии на металле и образует участки с повышенной активностью, что приводит к электрохимической коррозии.
Эти факторы влияют на скорость процесса электрохимической коррозии и механизмы, которые происходят на аноде металла. Определение и учет этих факторов позволяют принять меры по предотвращению коррозии и обеспечению долговечности металлических конструкций и изделий.
Пассивация металлов и ее влияние на развитие коррозии

Пассивация металлов – это процесс, при котором они приобретают защитный пассивный слой на поверхности, который является пассиватором и снижает скорость коррозии. В результате пассивации металлы становятся менее активными и более стойкими к агрессивным средам.
Пассивация обусловлена образованием на поверхности металла пассивного оксидного слоя путем окисления металла. Для большинства металлов пассиваторы могут быть различными оксидными пленками, например, оксид железа, оксид хрома или оксид алюминия.
Влияние пассивации на развитие коррозии определяется тем, что пленка пассиватора обладает высокой растворимостью в окружающей среде и ее формирование является динамическим процессом. Если пассивный слой разрушается из-за выброса химически активных частиц на поверхность или из-за механических воздействий, то процесс коррозии возобновляется.
Однако, при нахождении металла в пассивирующей среде и наличии пассивного покрытия на поверхности, скорость коррозии замедляется и сам процесс протекает с меньшей интенсивностью. Таким образом, пассивация металлов эффективно защищает их от разрушительного воздействия коррозии.
Меры по защите от электрохимической коррозии металлов на аноде
Электрохимическая коррозия металлов на аноде может иметь серьезные последствия для различных металлических конструкций и оборудования. Для защиты от этого процесса применяются различные меры, которые помогают увеличить срок службы металлов и предотвратить их нежелательное разрушение.
Одной из основных мер по защите от электрохимической коррозии металлов на аноде является применение покрытий. Покрытия могут быть нанесены на металл различными способами, например, путем окрашивания, гальванического осаждения, флуорирования и других методов. Такие покрытия создают барьер для взаимодействия металла с окружающей средой, что позволяет снизить процесс коррозии.
Еще одной эффективной мерой по защите от электрохимической коррозии является использование антикоррозионных покрытий. Эти покрытия содержат активные компоненты, которые образуют защитный слой на поверхности металла. Они могут быть нанесены как наружно (например, краска), так и внутрь (например, антикоррозионная паста). Такие покрытия образуют защитный слой, который позволяет предотвратить проникновение влаги и агрессивных химических веществ к металлу, что снижает вероятность коррозии.
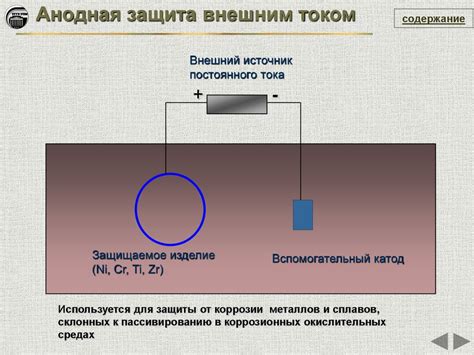
Другим важным способом защиты от электрохимической коррозии металлов на аноде является использование анодной защиты. Анодная защита представляет собой процесс, при котором на металлический объект подается постоянный электрический ток, что позволяет сделать объект анодом и изменить направление электрохимических процессов, предотвращая коррозию. Для анодной защиты используется специальное оборудование, включающее в себя источник постоянного тока, аноды, регулирующие и контролирующие устройства.
Таким образом, меры по защите от электрохимической коррозии металлов на аноде включают применение покрытий, антикоррозионных составов и анодной защиты. Комплексное использование этих мер позволяет увеличить срок службы металлических конструкций и оборудования, а также обеспечить их надежную защиту от воздействия агрессивных химических веществ и окружающей среды.
Вопрос-ответ

Что такое электрохимическая коррозия металлов на аноде?
Электрохимическая коррозия металлов на аноде - это процесс разрушения металла под воздействием электрического тока и химических реакций, происходящих на его поверхности. В результате коррозии на аноде металла образуются ионы, которые переносятся через электролит к катоду, а на металле образуются участки с повышенной электрохимической активностью.
Какие причины влияют на электрохимическую коррозию металлов на аноде?
На электрохимическую коррозию металлов на аноде влияют различные факторы. Основные причины коррозии включают присутствие влаги, наличие кислорода, избыток или недостаток электролита, изменение pH среды, механический или термический стресс, наличие агрессивных химических веществ, наличие других металлов или материалов, а также взаимодействие с различными микроорганизмами или биологическими средами.
Какие механизмы являются основными при электрохимической коррозии металлов на аноде?
При электрохимической коррозии металлов на аноде происходят различные механизмы. Основными механизмами являются окисление металла, анодный окислительный процесс и диффузия ионов в электролите. Окисление металла происходит на поверхности металла под воздействием кислорода или других окислителей в среде. Анодный окислительный процесс является основным процессом, при котором электроны отдаются металлом окружающему электролиту. Диффузия ионов в электролите обеспечивает перемещение ионов через электролит от анода к катоду.
