Металлы являются одним из основных классов материалов, обладающих кристаллической структурой. Образование такой структуры обусловлено особенностями атомов металлов и их взаимодействием друг с другом.
Атомы металлов обладают свободными электронами, которые могут перемещаться внутри кристаллической решетки. Это позволяет металлам обладать высокой электрической и теплопроводностью, а также пластичностью и прочностью.
Взаимодействие атомов металлов в кристаллической структуре происходит через электростатические взаимодействия. Атомы упорядочено располагаются в кристаллической решетке, образуя регулярные структурные элементы, такие как кристаллиты или зерна. Кристаллическая структура металлов придает им многочисленные полезные свойства, такие как твердость, способность к формованию и деформации, и коррозионную стойкость.
Причина образования кристаллической структуры у металлов заключается в принципе минимизации энергии системы. Атомы металлов стремятся занять наиболее энергетически выгодные позиции в кристаллической решетке, что приводит к образованию определенных симметричных структур, таких как кубическая, гексагональная или тетрагональная.
Кристаллическая структура металлов

Кристаллическая структура металлов – это особенность атомного устройства, которая объясняет их химические и физические свойства. Металлы обладают кристаллической структурой, которая возникает благодаря специфическому порядку расположения атомов.
Причина образования кристаллической структуры в металлах заключается в действии сил притяжения между атомами. Атомы металлов обладают свободными электронами, которые создают электронное облако вокруг атомов. Эти электроны обеспечивают электрическую проводимость металлов.
Кристаллическая структура металлов состоит из периодически повторяющихся структурных элементов, называемых элементарными ячейками. Самой распространенной кристаллической структурой металлов является кубическая решетка. В этой структуре атомы металла располагаются на вершинах и в центрах кубов.
Одной из причин образования кристаллической структуры в металлах являются взаимодействия между атомами, которые стремятся к минимизации потенциальной энергии системы. Кристаллическая структура обеспечивает наибольшую компактность и упорядоченность в расположении атомов.
Кристаллическая структура металлов имеет ряд свойств, таких как высокая электрическая и теплопроводность, пластичность и прочность. Эти свойства являются следствием особенностей атомного устройства металлов и способности атомов перемещаться внутри кристаллической решетки без ее разрушения.
Металлическая связь и кристаллическая структура

Металлическая связь – это особый тип связи между атомами в металлах, который обуславливает их уникальные свойства. В отличие от молекулярной связи, металлическая связь не фиксирует атомы в определенных местах, а позволяет им свободно двигаться. Атомы металла образуют кристаллическую структуру, где они упорядочены и расположены в регулярной сетке.
Кристаллическая структура металла состоит из кристаллических зерен, которые в свою очередь состоят из атомов, расположенных в упорядоченной структуре. Каждый атом металла окружен несколькими ближайшими атомами, образуя так называемую "решетку". Это позволяет атомам металла образовывать свободно двигающиеся электроны, что является основой металлической связи.
Металлическая связь обуславливает ряд особенностей металлов, таких как высокая электропроводность, теплопроводность и пластичность. Поскольку атомы металла не закреплены на определенных позициях в кристаллической структуре, они могут свободно передвигаться и обмениваться энергией с окружающими атомами. Это обеспечивает хороший контакт и передачу энергии между атомами металла.
Кристаллическая структура металла также определяет его механические свойства. Благодаря наличию упорядоченной структуры и упругим связям между атомами, металлы обладают высокой прочностью и устойчивостью к деформации. Кристаллические зерна в металлах также могут влиять на их микроструктуру и свойства, что делает их важными для многих промышленных применений.
Регулярное упорядочение атомов
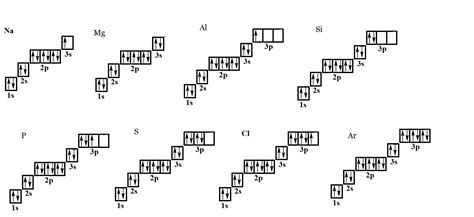
Структурная особенность металлов заключается в их способности образовывать регулярное упорядочение атомов, что и объясняет их кристаллическую структуру. В металлической решетке атомы располагаются таким образом, что каждый атом окружен сразу несколькими соседними атомами.
Этот регулярный порядок связан с специфическими электронными свойствами металлов. Внутренние электроны металла образуют так называемый электронный облако, которое распространяется по всей металлической решетке. Под действием электростатических сил электроны плотно связывают атомы друг с другом и создают регулярное упорядочение.
Кристаллическая структура металлов позволяет им обладать определенными механическими свойствами, такими как прочность и упругость. Регулярное расположение атомов обеспечивает равномерное распределение внутренних напряжений и позволяет металлам выдерживать большие нагрузки без разрушения.
Энергия и стабильность кристаллической структуры
Кристаллическая структура металлов обладает высокой стабильностью, что обеспечивает им прочность и долговечность. Эта стабильность связана с энергетическими характеристиками кристаллической решетки.
Кристаллическая структура металлов образуется благодаря силам, действующим между атомами или ионами, и энергии, необходимой для их перемещения. В металлах эти силы являются электростатическими, вызванными наличием свободных электронов в валентной зоне. Эти электроны взаимодействуют с положительно заряженными ионами металла, создавая межатомные и межионные связи.
Существует понятие энергии решетки – энергии взаимодействия атомов или ионов в кристаллической структуре металла. Эта энергия определяется как разность межатомных или межионных энергий, существующих между атомами или ионами в кристаллической решетке и в отдельности.
У металлов энергия решетки обычно отрицательна, что означает, что энергия в кристаллической решетке меньше, чем сумма энергий атомов или ионов в отдельности. Это объясняет стабильность кристаллической структуры металлов. При нарушении кристаллической структуры и разорвании межатомных или межионных связей энергия решетки увеличивается, что приводит к потере стабильности.
Таким образом, энергия решетки и стабильность кристаллической структуры металлов тесно связаны между собой. Высокая стабильность кристаллической структуры обеспечивает металлам их уникальные свойства, такие как прочность и пластичность, что делает их незаменимыми материалами во многих отраслях промышленности.
Влияние температуры на формирование кристаллической структуры
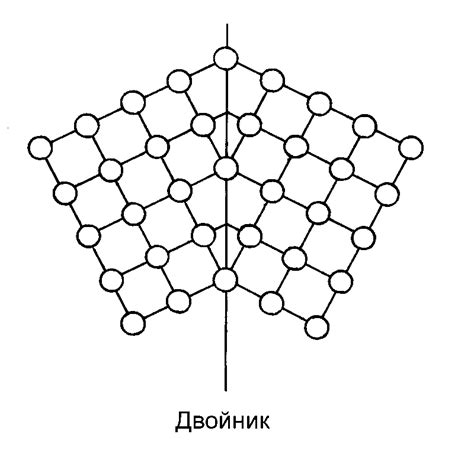
Температура играет важную роль в процессе формирования кристаллической структуры металлов. При повышении температуры происходит образование новых кристаллических зерен и изменение их размеров.
При низких температурах металлы обычно обладают очень плотной и упорядоченной кристаллической структурой. Атомы или ионы в металлах занимают фиксированные позиции и связаны друг с другом сильными межатомными связями. Это обеспечивает металлам высокую механическую прочность и твердость.
Однако при повышении температуры энергия атомов или ионов возрастает, что приводит к нарушению межатомных связей. Атомы начинают перемещаться и менять свои позиции, что приводит к образованию новых кристаллических порядков. Как результат, образуются границы между зернами, которые представляют собой области с различной ориентацией кристаллической структуры.
При достаточно высокой температуре возможно полное разрушение кристаллической структуры металла и переход в аморфное состояние. В этом случае атомы или ионы полностью потеряли упорядоченность и занимают случайные позиции.
Таким образом, температура оказывает существенное влияние на формирование кристаллической структуры металлов. Правильное контролирование температуры позволяет регулировать свойства металлов, такие как механическая прочность, твердость и пластичность.
Особенности кристаллической структуры различных металлов

Кристаллическая структура металлов зависит от их химического состава и способа охлаждения. Отличительной особенностью металлической кристаллической структуры является наличие регулярной упорядоченной решетки атомов, которая обеспечивает металлам их уникальные свойства: высокую пластичность, теплопроводность и электропроводность.
Металлы могут образовывать различные типы кристаллических структур. Наиболее распространенные кристаллические структуры металлов - кубическая гранецентрированная решетка (ГЦК), кубическая гранецентрированная решетка (ГЦК) и шестигранная группа решетки (ШГР). Каждая из этих структур имеет свои характеристики и связана с определенными металлическими материалами.
К примеру, кубическая гранецентрированная решетка характерна для таких металлов, как железо, никель и алюминий. Эта структура обеспечивает металлам высокую прочность и устойчивость к деформациям. Кубическая гранецентрированная решетка включает в себя атомы, расположенные на углах и в центре каждой грани единичной ячейки.
Кубическая решетка с гранями в центрах, между атомами, является характерной для алюминия и меди. Эта структура обеспечивает металлам высокую электропроводность и хорошую коррозионную стойкость.
Шестигранная группа решетки характерна для таких металлов, как цинк и магний. Она образуется путем расположения атомов в узлы шестигранной призмы и обеспечивает металлам прочность, низкую плотность и хорошую пластичность.
Таким образом, различные металлы имеют свои характерные кристаллические структуры, которые определяют их уникальные свойства и позволяют использовать их в различных сферах промышленности.
Вопрос-ответ

Почему металлы образуют кристаллическую структуру?
Металлы образуют кристаллическую структуру из-за особенностей их атомного строения. Атомы металлов имеют свободные электроны, которые могут перемещаться по всей структуре. Это позволяет атомам металлов сложиться в регулярную и упорядоченную кристаллическую решетку.
Какова роль свободных электронов в образовании кристаллической структуры металлов?
Свободные электроны играют ключевую роль в образовании кристаллической структуры металлов. Они создают металлическую связь между атомами, позволяя им сложиться в регулярную и упорядоченную кристаллическую решетку. Благодаря свободным электронам металлы обладают высокой электропроводностью и теплопроводностью.
Какие факторы определяют форму и размеры кристаллов в металлах?
Форма и размеры кристаллов в металлах определяются несколькими факторами. Во-первых, основную роль играет скорость охлаждения расплавленного металла. Быстрая охладка способствует образованию мелких кристаллов, а медленная - больших. Во-вторых, влияние на форму кристаллов имеет деформация металла при обработке и кристаллизация в условиях внешней среды.
Как влияет добавление легирующих элементов на кристаллическую структуру металлов?
Добавление легирующих элементов может значительно изменить кристаллическую структуру металлов. Легирующие элементы могут образовывать растворы твердого раствора с основным металлом, что приводит к изменению размеров и формы кристаллов. Кроме того, легирующие элементы могут вносить дефекты и изменять химические свойства металла.
