Щелочные металлы, такие как литий, натрий и калий, обладают высокой активностью и химической реактивностью. Одной из самых известных реакций данных металлов является их взаимодействие с водой. В результате этого взаимодействия образуется щелочь – водный раствор гидроксидов, который характеризуется щелочной средой.
Образование щелочи при взаимодействии щелочных металлов с водой происходит в результате реакции, при которой металл активно взаимодействует с молекулами воды. В результате этой реакции образуются гидроксид металла и молекулы водорода. Гидроксид металла, являясь растворимым в воде соединением, становится щелочью, которая имеет высокую щелочность.
Образование щелочной среды при взаимодействии щелочных металлов с водой имеет важное значение как в химической промышленности, так и в научных исследованиях. Щелочные растворы используются в различных областях, включая производство мыла и стекла, очистку сточных вод, регулирование pH в лаборатории и другие процессы. Поэтому, изучение образования щелочи является важной задачей для понимания и применения щелочных металлов в различных отраслях науки и промышленности.
Щелочные металлы – основные химические элементы
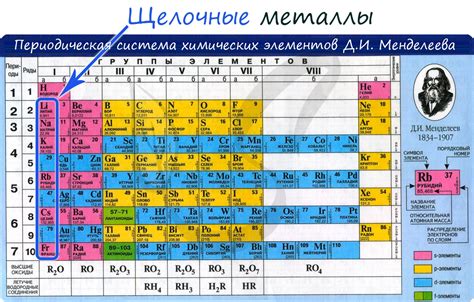
Щелочные металлы - это группа химических элементов, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они относятся к первой группе периодической системы химических элементов и обладают схожими свойствами.
Основным свойством щелочных металлов является их способность образовывать щелочные растворы при взаимодействии с водой. Каждый из этих элементов активно взаимодействует с водой, образуя гидроксиды, которые имеют сильно щелочную реакцию.
Например, литий реагирует с водой, образуя гидроксид лития (LiOH). Опускаяся ниже в таблице, натрий образует натриевый гидроксид (NaOH), а калий образует калиевый гидроксид (KOH). Реакции взаимодействия рубидия, цезия и франция с водой протекают аналогичным образом и приводят к образованию соответствующих щелочных гидроксидов.
Щелочные металлы широко используются в различных отраслях промышленности и научных исследованиях. Их соединения находят применение в производстве щелочей, стекла, мыла и других химических веществ. Кроме того, щелочные металлы играют важную роль в биологии, включая участие в обмене ионами в клетках организмов.
Реакция щелочных металлов с водой

Щелочные металлы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs), проявляют химическую реакцию при контакте с водой. При этом образуется щелочная среда, а в результате взаимодействия металлов с водой выделяется водород (H2). Эта реакция является химической характеристикой щелочных металлов и используется для определения их наличия и исследования их свойств.
Реакция начинается с проведения электронов из внешней оболочки щелочного металла на атомы водного молекула. Это приводит к разрыву связи между атомами кислорода и водорода, образуя гидроксид (OH-) и освобождая водородные ионы (H+). Гидроксид, который образуется в результате реакции, делает среду щелочной, а водород выделяется в виде газа.
Реактивность щелочных металлов в воде увеличивается с увеличением порядкового номера элемента в периодической системе. Например, литий реагирует медленно и спокойно, в то время как калий и цезий реагируют очень быстро и сильно. Это связано с различными электрохимическими свойствами и энергией ионизации металлов.
- Литий (Li): 2Li + 2H2O → 2LiOH + H2
- Натрий (Na): 2Na + 2H2O → 2NaOH + H2
- Калий (K): 2K + 2H2O → 2KOH + H2
- Рубидий (Rb): 2Rb + 2H2O → 2RbOH + H2
- Цезий (Cs): 2Cs + 2H2O → 2CsOH + H2
Эта реакция широко используется не только в химических исследованиях, но и в промышленности. Например, водородный газ, который выделяется в результате реакции щелочных металлов с водой, используется как источник энергии, в производстве азотной кислоты и других химических соединений.
Получение щелочи
Щелочь - это тип химических веществ, которые образуют щелочные растворы в воде. Получение щелочи осуществляется путем взаимодействия щелочных металлов с водой. Щелочные металлы включают натрий, калий, литий и другие элементы из первой группы периодической системы.
Взаимодействие щелочных металлов с водой происходит по следующему принципу: металл реагирует с водой, выделяется водород и образуется гидроксид металла, который и является щелочью. Химическое уравнение для этой реакции может быть записано следующим образом:
2M + 2H₂O → 2MOH + H₂
Гидроксид металла растворяется в воде, образуя щелочной раствор. Этот раствор обладает рядом характеристических свойств, таких как щелочная реакция и способность нейтрализовать кислоты.
Использование щелочных растворов имеет широкий спектр применений. Они используются в бытовых, технических и промышленных целях. Например, щелочи применяются в моющих средствах, производстве стекла, мыле, щелочных батареях и других областях.
Таким образом, получение щелочи путем взаимодействия щелочных металлов с водой является важным процессом, который позволяет получать химически активные вещества с различными применениями.
Химические свойства щелочных металлов

Щелочные металлы — это элементы первой группы (IА) периодической таблицы, к которым относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У этих металлов есть ряд характерных химических свойств.
Первое отличительное свойство щелочных металлов — их высокая реакционность с водой. При контакте с водой они образуют щелочи и выделяются водород. Такая реакция называется гидролизом. Каждый металл из этой группы имеет разную интенсивность реакции с водой, но в целом она происходит с выделением значительного количества энергии.
Второе характерное свойство — образование щелочей при реакции с водой. Щелочи являются гидроксидами щелочных металлов и обладают высоким щелочным рН. Например, литий реагирует с водой, образуя гидроксид лития (LiOH), который действует как щелочь и имеет щелочной рН.
Третье химическое свойство щелочных металлов — образование ионов в растворах. При растворении металлов в воде образуются катионы, которые имеют положительный заряд. Например, натрий при растворении образует ионы Na+, а калий — ионы K+. Эти ионы являются ключевыми компонентами щелочных растворов и обладают особыми электрохимическими свойствами.
Применение щелочи в промышленности

Щелочные вещества, такие как гидроксид натрия (NaOH) и гидроксид калия (КОН), имеют широкое применение в различных отраслях промышленности. Они являются ключевыми компонентами многих процессов и обладают рядом полезных химических свойств.
Одним из самых распространенных применений щелочи в промышленности является производство мыла и моющих средств. Гидроксид натрия используется для щелочного гидролиза жиров, что позволяет получить мыло. Они также используются для регулирования pH в косметических и гигиенических продуктах.
Щелочные вещества также используются в текстильной промышленности для отбеливания и обработки тканей. Они помогают удалить пятна и загрязнения, улучшают яркость и стойкость красителей. Кроме того, гидроксид натрия используется в процессе мерсеризации, который придает тканям улучшенные свойства, такие как устойчивость к усадке и блеск.
Щелочи широко применяются также в пищевой промышленности. Гидроксид натрия используется для регулирования pH, консервации и обработки продуктов. Они также используются в производстве шоколада, пива и предполагаются в процессе очистки грязи, рассольных жиж и жиров.
В промышленности щелочи часто используются как растворители для различных веществ. Например, гидроксид натрия используется для удаления жира и устранения загрязнений на металлических поверхностях. Они также используются в производстве бумаги, стекла, промышленности целлюлозы и бумаги.
Все это делает щелочи очень важными и неотъемлемыми веществами для промышленности и многих других отраслей деятельности. Их разнообразное применение и полезные свойства делают их незаменимыми компонентами для многих процессов и производств.
Влияние щелочи на окружающую среду

Взаимодействие щелочных металлов с водой является процессом, который приводит к образованию щелочной среды. Сильные щелочи, такие как натрий и калий, обладают высокой щелочностью и могут оказывать влияние на окружающую среду.
Одним из основных последствий воздействия щелочи на окружающую среду является изменение pH-уровня водных систем, таких как реки, озера и океаны. Это может привести к нарушению экосистемы, поскольку многие организмы и микроорганизмы зависят от определенного pH-уровня для своей жизнедеятельности.
Кроме того, сильные щелочи могут оказывать разрушительное воздействие на растительный и животный мир водных систем. Они могут вызывать вымирание рыб и других водных организмов, а также приводить к гибели водных растений.
Также стоит отметить, что щелочные металлы могут оказывать коррозионное действие на металлические конструкции и объекты в окружающей среде. Это может привести к повреждению инфраструктуры, такой как мосты, трубопроводы и здания.
Для минимизации негативного влияния щелочи на окружающую среду необходимо контролировать и управлять процессом образования щелочной среды, а также предпринимать меры по очистке и восстановлению водных экосистем после воздействия щелочи.
Вопрос-ответ

Почему при взаимодействии щелочных металлов с водой образуется щелочь?
При взаимодействии щелочных металлов с водой происходит реакция, в результате которой образуется щелочь. Щелочные металлы, такие как натрий, калий и другие, имеют низкую электроотрицательность и легко отдают электроны. Вода, в свою очередь, состоит из молекул, которые имеют полярное строение. Когда щелочный металл погружается в воду, электроны отделяются от металла и передаются водным молекулам. При этом молекулы воды становятся отрицательно заряженными и образуется гидроксид ион - основа или щелочь. Таким образом, образование щелочи при взаимодействии щелочных металлов с водой происходит из-за передачи электронов от металла к воде.
Какие именно щелочные металлы образуют щелочь при взаимодействии с водой?
Щелочные металлы, такие как натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr), образуют щелочь при взаимодействии с водой. Эти металлы имеют низкую электроотрицательность и являются активными химическими элементами. При контакте с водой они легко передают электроны в молекулы воды, вызывая образование щелочи.
Какова реакция между щелочными металлами и водой?
Реакция между щелочными металлами и водой происходит следующим образом: металл реагирует с водой, отдавая электроны молекулам воды. Например, при взаимодействии натрия (Na) с водой (H2O) образуется гидроксид натрия (NaOH) и выделяется водород (H2). Эта реакция можно записать следующим образом: 2Na + 2H2O -> 2NaOH + H2. Таким образом, основная реакция между щелочными металлами и водой приводит к образованию основы или щелочи и выделению водорода.
