Металлы являются важной частью нашей повседневной жизни. Они используются во множестве отраслей, включая строительство, автомобильную промышленность, электронику и многие другие. При взаимодействии с другими металлами металлы проявляют только химическую реакцию, влияющую на их структуру и свойства. Эта химическая реакция может быть как положительной, так и отрицательной, и может привести к образованию сплавов или коррозии.
Один из основных способов взаимодействия металлов - это образование сплавов. Сплавы представляют собой смеси двух или более металлов, которые позволяют им обладать новыми свойствами, недоступными отдельным компонентам. Обычно сплавы создают, чтобы улучшить прочность, твердость или устойчивость к коррозии металлов. Например, сплавом железа и углерода является сталь, которая обладает высокой прочностью и твердостью.
Однако взаимодействие металлов может быть также отрицательным, проявляющимся в виде коррозии. Коррозия - это процесс разрушения металла в результате его взаимодействия с окружающей средой, такой как кислород, вода или агрессивные химические вещества. Эта химическая реакция может приводить к потере свойств металла и его прежнего внешнего вида. Поэтому, для защиты и продления срока службы металлических конструкций, требуется применение специальных покрытий или антикоррозионных материалов.
В целом, взаимодействие металлов с другими металлами проявляется только через химическую реакцию, которая может привести как к созданию новых материалов с расширенными свойствами, так и к разрушению их структуры из-за коррозии. Понимание этих процессов позволяет разрабатывать более прочные и долговечные металлические изделия, а также разрабатывать новые сплавы и антикоррозионные технологии.
Металлы и их реакция

Металлы, будучи активными элементами, проявляют химическую реакцию при взаимодействии с другими веществами. Их переход в оксиды, гидроксиды и соли является типичной реакцией, называемой окислительно-восстановительной.
Одной из наиболее распространенных реакций металлов является окисление металла воздухом. При этом на поверхности металла образуется оксидный слой, который защищает металл от дальнейшего окисления. Некоторые металлы, такие как железо и алюминий, образуют тонкие слои оксида, которые благодаря своей прочной структуре препятствуют дальнейшей реакции металла с окружающей средой.
Однако некоторые металлы, такие как магний и цинк, реагируют с водой, высвобождая водород. Реакция обычно протекает с выделением тепла и происходит достаточно интенсивно. Эти металлы встречаются в жизни чаще, поскольку они менее склонны к окислению и активнее вступают в химические реакции.
Также металлы могут образовывать соли с различными кислотами. Например, железо образует сульфаты и хлориды, алюминий - альминиевые соли, медь - сульфат меди и многие другие. Образующиеся соли могут иметь различные свойства и применения, поэтому изучение реакций металлов с кислотами имеет большое практическое значение.
Металлическая структура
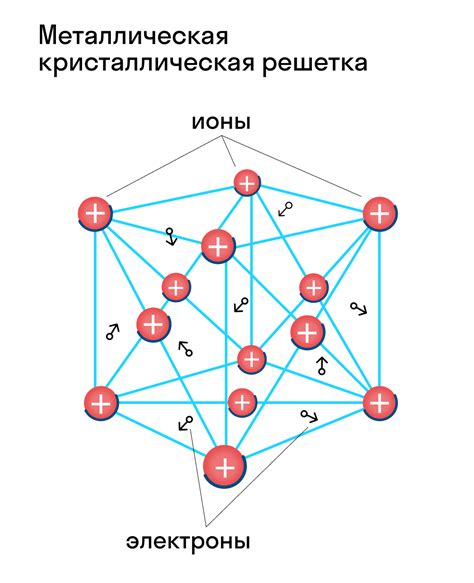
Металлическая структура представляет собой особое упорядоченное расположение атомов в металле. Кристаллическая решетка металлов характеризуется наличием системы упорядоченных атомных рядов. В металлической структуре атомы металла формируют кристаллическую решетку, что придает металлам особые свойства, такие как высокая прочность и электропроводность.
Отличительной особенностью металлической структуры является свободное движение электронов внутри металла. Межатомные связи в металлической структуре обеспечиваются перемещением электронов от одного атома к другому, что позволяет металлам обладать высокой проводимостью электричества и тепла. Благодаря этому металлы широко применяются в различных областях техники и промышленности.
В металлической структуре есть особое расположение атомов, которое называется сжатым упакованным типом решетки. В этом типе решетки каждый атом окружен шестью ближайшими соседями и имеет максимально плотное упакованое расположение. Благодаря такому расположению атомов, металлы обладают хорошей прочностью, что делает их идеальными для использования в конструкционных материалах.
Механизм химических реакций
Химические реакции представляют собой процессы превращения одних веществ в другие. Они происходят на молекулярном уровне и основаны на принципе сохранения вещества. Механизмы химических реакций представляют собой последовательность шагов, включающих в себя образование и разрыв химических связей между атомами.
Процесс химической реакции начинается с образования активированного комплекса – временного состояния, в которое переходят исходные вещества перед образованием конечных продуктов реакции. Этот этап называется стадией активации, и он требует энергии для преодоления энергетического барьера.
Существуют различные механизмы химических реакций, которые определяются природой взаимодействующих веществ и условиями реакции. Например, механизмы реакций могут быть радикальными, ионными или координационными.
Радикальные механизмы характерны для реакций, при которых происходит разрыв и образование связей через образование радикалов – активных атомов или групп атомов, обладающими неспаренным электроном. Ионные механизмы включают образование ионов, электронный перенос и формирование новых связей между ионами. Координационные механизмы основаны на взаимодействии комплексов из атомов или ионов, которые вступают в реакцию посредством обмена лигандами – молекулами, образующими связь с центральным атомом или ионом.
Окисление металлов

Окисление металлов - это процесс, при котором металлы вступают в химическую реакцию с кислородом из воздуха или с другими окислителями, что приводит к образованию оксидов металлов.
Процесс окисления металлов непосредственно связан с электрохимическими реакциями. Во время окисления, металлы теряют электроны и превращаются в положительно заряженные ионы, которые растворяются в растворах или оседают на поверхности металла в виде оксидов.
Окисление металлов может происходить при разных условиях, включая наличие влажности, температуру, кислотность окружающей среды и наличие других агентов окисления. Некоторые металлы, такие как магний и алюминий, имеют способность к быстрому окислению при контакте с воздухом, в то время как другие металлы, такие как золото и платина, обладают высокой стойкостью к окислению.
Окисление металлов может привести к различным результатам, включая потерю блеска металла, изменение его цвета, образование покрытий или оксидных слоев. Некоторые оксиды металлов могут быть полезными и использоваться для защиты металла от дальнейшего окисления или для создания декоративных эффектов.
В таблице ниже приведены некоторые примеры окисления металлов:
| Металл | Окислитель | Продукт окисления |
|---|---|---|
| Железо | Кислород | Ржавчина (оксид железа) |
| Алюминий | Кислород | Алюминиевая корка (оксид алюминия) |
| Медь | Вода | Зеленая синяя патина (оксид меди) |
Окисление металлов является естественным процессом, который может привести к преждевременному старению и повреждению металлических изделий. Поэтому важно принимать меры по защите металлов от окисления, такие как нанесение защитных покрытий или хранение в специальных условиях.
Подвергаются ли металлы противодействию других веществ?
Металлы свойства взаимодействия с другими веществами и их противодействие.
Металлы, взаимодействуя с другими веществами, могут проявлять как химические, так и физические реакции. Однако, наиболее явно металлы проявляют химическую реакцию при взаимодействии с другими веществами.
При контакте с водой многие металлы образуют гидроксиды и выделяются водород. Например, натрий реагирует с водой, образуя гидроксид натрия и выделяя водород.
Металлы также могут противодействовать кислотам, образуя соли и выделяя водород. Некоторые металлы, например, цинк и железо, активно реагируют с кислотами, что может быть использовано, например, для очистки ржавчины с поверхности металлических изделий.
Однако, не все металлы проявляют химическую реакцию при взаимодействии с другими веществами. Некоторые металлы, такие как золото и платина, являются химически инертными и практически не реагируют с другими веществами.
Поэтому, можно сказать, что металлы, в общем случае, подвергаются противодействию других веществ, особенно химическим реакциям, но характер этого взаимодействия зависит от свойств конкретного металла и его способности к реакции с другими веществами.
Экологические последствия взаимодействия металлов

Взаимодействие металлов с окружающей средой может иметь серьезные экологические последствия, которые могут негативно влиять на живые организмы и экосистемы. Одной из основных проблем является загрязнение воды. Многие металлы могут вымываться из своих природных источников, таких как руды или грунт, и попадать в реки, озера и океаны.
Когда металлы попадают в воду, они могут вызывать различные экологические проблемы. Некоторые металлы, такие как свинец, ртуть и кадмий, являются токсичными и могут накапливаться в тканях рыб и других водных организмов. При употреблении таких рыб в пищу, эти металлы могут представлять угрозу для здоровья людей.
Кроме того, металлы могут оказывать негативное влияние на растительный мир. Они могут угнетать рост растений, что приводит к снижению урожайности и ухудшению качества пищевых продуктов. Некоторые металлы также могут накапливаться в почве и оставаться в ней на протяжении длительного времени.
Без должного управления и мер по контролю загрязнения металлами, их воздействие на окружающую среду может иметь серьезные последствия для биологического разнообразия и экосистем. Поэтому важно принимать меры по промышленной безопасности и разработке технологий, которые позволят минимизировать уровень выбросов металлов и обеспечить их безопасную обработку и утилизацию.
Вопрос-ответ

В чем заключается химическая реакция при взаимодействии металлов с другими металлами?
При взаимодействии металлов происходит химическая реакция, которая может проявляться в различных формах, таких как окисление, редукция или образование сплавов. Например, при контакте железа и кислорода происходит окисление, которое приводит к образованию ржавчины.
Какие металлы проявляют химическую реакцию при взаимодействии с другими металлами?
Химическая реакция при взаимодействии с другими металлами проявляется у большинства металлов. Например, алюминий реагирует с ржавчиной, что приводит к образованию гидроксида алюминия и выделению водорода.
Есть ли металлы, которые не проявляют химическую реакцию при взаимодействии с другими металлами?
Металлы, которые являются химически нейтральными и не проявляют химическую реакцию при взаимодействии с другими металлами, называются инертными металлами. К ним относятся золото и платина.
Какие изменения происходят в металлах во время химической реакции?
Во время химической реакции с другими металлами металлы могут изменять свою структуру, форму, цвет и свойства. Например, при образовании сплава из двух металлов, образуется материал с новыми свойствами, такими как повышенная прочность или плавучесть.
Каковы практические применения химической реакции металлов с другими металлами?
Химическая реакция металлов с другими металлами имеет множество практических применений. Например, сплавы металлов используются в производстве различных материалов, таких как сталь для строительства или алюминиевый сплав для авиационной промышленности. Также, реакция металлов с кислородом способствует устранению ржавчины и защите металлов от коррозии.
