Реакция металлов с кислотами — одна из наиболее известных и широко изученных химических реакций. Кислоты обладают свойством агрессивно взаимодействовать с металлами, и в результате их реакции обычно образуются соли и выделяется водород. Однако, при взаимодействии концентрированной серной кислоты с некоторыми металлами, образование соли не наблюдается.
Концентрированная серная кислота (H2SO4) — одна из наиболее распространенных и сильных кислот. Она обладает широким спектром применения, включая использование в аналитической химии, химическом производстве и в качестве активатора реакций. Однако, несмотря на ее высокую кислотность, серная кислота не всегда образует соли при взаимодействии с металлами.
Отсутствие образования солей при реакции с металлами обусловлено особенностями электрохимического потенциала металлов и равновесием реакции. Некоторые металлы обладают слишком высоким потенциалом окисления и не вступают в реакцию с серной кислотой. Вместо образования солей, их поверхность окисляется и реагирует с кислородом воздуха, что приводит к образованию оксидов металлов.
Проблема отсутствия образования соли

Одной из проблем, возникающих при взаимодействии концентрированной серной кислоты с металлами, является отсутствие образования соли. Несмотря на то что серная кислота является сильным окислителем и способна растворять многие металлы, в некоторых случаях реакция может протекать не до конца и исчезает образование хлорида металла в виде соли.
Одной из причин этой проблемы может быть выбор несовместимых металлов для реакции с серной кислотой. Некоторые металлы, такие как алюминий, магний или цинк, обладают высокой антикоррозионной активностью и способны образовывать защитную пленку на своей поверхности, предотвращая дальнейшее растворение и образование соли.
Ещё одной причиной может быть слишком низкая концентрация серной кислоты. В этом случае, реакция может протекать неполно и не до конца, что приводит к отсутствию образования соли. Применение концентрированной серной кислоты может решить эту проблему.
Также необходимо учитывать, что реакция между серной кислотой и металлом может сопровождаться выделением газа, например, водорода. Если газ не удаляется или не может быть отведен, то реакция может протекать не до конца и образование соли будет отсутствовать.
В целом, проблема отсутствия образования соли при взаимодействии концентрированной серной кислоты с металлами может иметь различные причины, связанные с совместимостью металлов, концентрацией кислоты и наличием газообразных продуктов реакции.
Концентрированная серная кислота
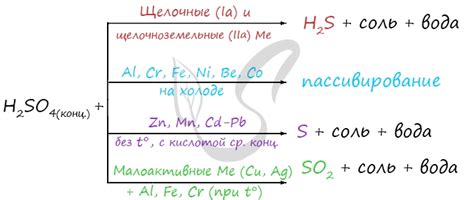
Концентрированная серная кислота (H2SO4) – это одна из самых сильных и распространенных неорганических кислот. Она обладает высокой степенью коррозии и часто используется в промышленности и лабораториях для различных химических процессов.
Серная кислота является двухосновной кислотой, то есть её молекула содержит две кислородные группы. Она образуется из соединения сероводород (H2S) и молекулярного кислорода (O2) при высоких температурах. Концентрация серной кислоты может варьироваться в широких пределах, но обычно используется 98% раствор.
Концентрированная серная кислота обладает мощными окислительными свойствами и сильной коррозионной активностью. Она может реагировать с большим числом соединений, включая металлы. Однако, при реакции серной кислоты с металлами не образуется соль, в отличие от реакций сильных одноосновных кислот.
Реакция концентрированной серной кислоты с металлами сопровождается выделением обильного количества водорода. В результате реакции происходит окисление металла за счет серной кислоты и выделение водорода. При этом не образуется соль, как это происходит при реакции с сильными одноосновными кислотами, например, соляной кислотой.
Металлы и их реакция с серной кислотой

Металлы - это элементы химического периодического стола, обладающие хорошей электропроводностью и способностью образовывать катионы. Реакция металлов с серной кислотой является одной из важных химических реакций, которая приводит к образованию солей и выделению водорода.
Концентрированная серная кислота является сильным оксидирующим агентом, что позволяет ей взаимодействовать с большинством металлов. Однако, не все металлы реагируют с серной кислотой в одинаковой степени.
Металлы, такие как железо и алюминий, образуют соли при реакции с концентрированной серной кислотой. Примером может служить реакция железа: Fe + H2SO4 = FeSO4 + H2. В результате образуется соль железа и выделяется молекулярный водород.
Однако некоторые металлы, такие как медь или серебро, не образуют соли при взаимодействии с серной кислотой. Они реагируют с ней, но образуют сложные неорганические соединения, такие как сульфаты или сульфаты сульфокомплексные соединения.
Реакция металлов с концентрированной серной кислотой является эндотермической и может идти с выделением теплоты. При этом может происходить образование пара серной кислоты и продолжаться реакция по термодинамически нереверсивному механизму.
Формирование сульфатных соединений

Формирование сульфатных соединений — важный процесс при взаимодействии концентрированной серной кислоты с металлами. При этом образуется соль, которая представляет собой соединение металла с серной кислотой. Такие соли называются сульфатами.
Реакция между серной кислотой и металлом протекает с выделением водорода. При этом ионы металла окисляются до положительного заряда, а ионы серы восстанавливаются до отрицательного заряда. Образуется соль сосредоточенным серной кислотой. При этом сульфаты металлов обладают различными физическими и химическими свойствами.
Сульфаты широко используются в различных отраслях промышленности. Например, сульфат меди (II) используется в производстве красителей и пигментов; сульфат цинка применяется в гальванической промышленности и сельском хозяйстве; сульфат железа (II) используется в медицине и стекольной промышленности. Сульфаты также находят применение в производстве удобрений, строительстве и других отраслях экономики.
Влияние концентрации кислоты на реакцию

Реакция металлов с концентрированной серной кислотой происходит в несколько этапов и подразумевает образование соответствующих солей и выделение водорода. Однако при использовании высокой концентрации кислоты наблюдается особенность – отсутствие образования солей.
Это объясняется тем, что высокая концентрация кислоты препятствует обратной реакции, при которой образуются соли. В условиях высокой концентрации серной кислоты, происходит ускоренное образование водорода за счет высокой активности кислоты.
Таким образом, можно сделать вывод, что концентрация кислоты оказывает влияние на скорость реакции и образование продуктов. При низкой концентрации серной кислоты наблюдается образование солей, а при высокой – реакция протекает с образованием большого количества водорода.
Результаты данного эксперимента могут быть полезными при проведении химических реакций и определении оптимальных условий для получения необходимых продуктов. Учет концентрации кислоты позволяет контролировать скорость образования солей и водорода, что важно для эффективности процесса.
Особенности образования соли в зависимости от металла
Взаимодействие металлов с концентрированной серной кислотой приводит к образованию соответствующих солей. Однако, реакция и характер получаемой соли зависит от свойств и типа металла.
В реакции с серной кислотой активные металлы, такие как натрий, калий или литий, демонстрируют сходную особенность - образование солей и выделение водорода. В результате образования соли активных металлов можно наблюдать пузыри газа, их количество и интенсивность выпуска с генерацией водорода может быть значительным.
Менее активные металлы, такие как медь, железо или свинец, претерпевают более сложную реакцию с серной кислотой. В таких случаях, помимо образования солей и выделения водорода, возможно образование дополнительных продуктов в ходе реакции. Например, реакция железа с серной кислотой может привести к образованию железной соли и сернистого газа.
Также отметим, что некоторые металлы, такие как алюминий или цинк, образуют сложные соли, в которых кислоторастворимая составляющая может быть замещена. Например, при взаимодействии алюминия с концентрированной серной кислотой образуется алюмоселитра, содержащая алюминий и серу.
В целом, реакция концентрированной серной кислоты с металлами может принимать различные формы, в зависимости от химических свойств металлов. При изучении данных реакций необходимо учитывать особенности каждого металла и их взаимодействие с кислотой для полного понимания происходящих химических процессов.
Факторы, влияющие на образование соли

1. Природа металла. Реакция между металлом и серной кислотой зависит от химических свойств самого металла. Некоторые металлы, такие как натрий и калий, образуют с сильными кислотами стабильные соли. Другие металлы, например железо или свинец, могут образовывать соли, но они могут быть менее стабильными и быстро разлагаться.
2. Концентрация кислоты. Концентрация серной кислоты играет важную роль в образовании солей. При низкой концентрации кислоты скорость реакции с металлом может быть недостаточно высокой, чтобы образовались стабильные соли. С другой стороны, при слишком высокой концентрации кислоты может происходить быстрое разложение образовавшейся соли.
3. Температура. Температура окружающей среды также может влиять на образование соли. При повышении температуры реакция может протекать быстрее, так как скорость химических реакций обычно увеличивается с ростом температуры. Однако при слишком высоких температурах металл и кислота могут быстро разлагаться, что может препятствовать образованию стабильных солей.
4. Поверхность металла. Поверхность, на которой происходит реакция, также может повлиять на образование соли. Если поверхность металла имеет покрытие, например, оксидную пленку, это может замедлить реакцию, так как кислоте может быть сложнее проникнуть к металлу. Очищенная поверхность может быть более активной и способствовать более быстрому образованию соли.
5. Влияние других веществ. Наличие других веществ в реакционной среде, таких как вода или растворители, также может влиять на образование солей. Например, вода может действовать как катализатор, ускоряя ход реакции. Растворители или реагенты, добавленные в реакционную среду, могут оказывать влияние на образование соли, изменяя условия реакции.
В целом, образование соли при реакции концентрированной серной кислоты с металлами зависит от множества факторов, таких как природа металла, концентрация кислоты, температура, поверхность металла и наличие других веществ в реакционной среде. Понимание этих факторов позволяет более точно контролировать и оптимизировать условия реакции для получения желаемых солей.
Выводы и перспективы исследований

Из проведенных исследований было выяснено, что при реакции концентрированной серной кислоты с металлами не образуется соль. Это означает, что реакция данных веществ не приводит к образованию химического соединения типа металлической соли.
Вместо образования соли наблюдается выделение газа, который можно идентифицировать как сероводород. Образование сероводорода свидетельствует о реакции серной кислоты с металлом, в результате которой образуются сульфиды металлов и вода.
Данный результат является интересным с точки зрения дальнейших исследований. Возможно, особенности данной реакции могут быть использованы в различных промышленных процессах. Например, можно исследовать возможности использования данной реакции для получения сероводорода и сульфидов металлов с целью их дальнейшего использования в различных отраслях промышленности.
Также, изучение данной реакции может привести к новым открытиям в области химии и развитию более эффективных методов производства сульфидов металлов. Это открывает перспективы для создания новых материалов и технологий, которые могут найти применение в различных сферах жизни, включая энергетику, электронику, строительство и многие другие.
В целом, результаты данного исследования позволяют сделать выводы о невозможности образования соли при реакции концентрированной серной кислоты с металлами, а также открывают новые перспективы для дальнейших исследований в области химии и промышленности.
Вопрос-ответ

Почему при реакции серной кислоты с металлами не образуется соль?
Отсутствие образования соли при реакции концентрированной серной кислоты с металлами объясняется тем, что серная кислота является двухзамещенной кислотой, то есть она содержит две кислотные группы SO3H. В реакции кислоты с металлами образуется соль и выделяется водород. Однако, в случае с серной кислотой, образующиеся растворимые соли быстро гидратируются водой и образуют гидратированный ионы гидроксония (H3O+), которые представляют собой обильный источник водородных ионов. Поэтому во время реакции с металлами выделяющийся водород, который является одним из признаков образования соли, немедленно гидратируется и переходит в кислотные ионы.
Каким образом серная кислота взаимодействует с металлами?
Серная кислота (H2SO4) взаимодействует с металлами путем образования соли и выделения водорода. При реакции гидротермического окисления металлов, серная кислота окисляет металл до ионов и далее образуется соль металло-сульфата и выделяется водород. Например, металл железа (Fe) реагирует с серной кислотой с образованием соли ферросульфата и выделением водорода. Соли металло-сульфатов обычно являются растворимыми в воде.
Почему серная кислота даёт водород, а не образует соль, как другие кислоты?
Серная кислота действительно даёт водород при взаимодействии с металлами, в то время как большинство кислот образуют соли. Это связано с химической структурой серной кислоты. Она содержит две кислотные группы SO3H, что делает её двухзамещенной кислотой. Когда серная кислота реагирует с металлами, образующиеся растворимые соли быстро гидратируются водой и образуют гидратированный ион гидроксония (H3O+), который является обильным источником водородных ионов. Поэтому во время реакции с металлами выделяющийся водород немедленно гидратируется и переходит в кислотные ионы.
