Азот и активные металлы – группа элементов, обладающих высокой реакционной способностью и широкими областями применения. Азот является одним из основных элементов, составляющих живые организмы, а активные металлы, такие как литий, натрий и калий, широко используются в различных областях науки и промышленности.
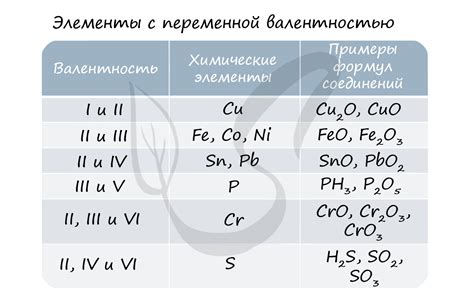
Одной из интересных особенностей взаимодействия азота и активных металлов является равенство степени окисления в соответствующих оксидах и нитридах этих элементов. Например, в оксиде лития (Li2O) и нитриде лития (Li3N) степень окисления лития равна +1.
Такое равенство степени окисления является следствием электрохимической активности азота и активных металлов. В обоих случаях азот, будучи значительно более электроотрицательным элементом, притягивает электроны от металла, что приводит к образованию ионов с отрицательным зарядом. В результате образуются соединения, в которых степень окисления металла составляет +1, а азота –3.
Таким образом, равенство степени окисления азота и активных металлов позволяет предсказывать образование и свойства их соединений, а также использовать эти знания в химической промышленности и других областях. Например, нитриды активных металлов широко применяются в качестве катализаторов, материалов для изготовления электроники и лазерных устройств.
Исследование равенства степени окисления азота и активных металлов является важным направлением в химии, и может привести к развитию новых и более эффективных методов синтеза соединений с использованием этих элементов. Это позволит расширить технологические возможности и применение активных металлов в различных областях науки и промышленности.
Азот и активные металлы: степень окисления
Азот (N) и активные металлы, такие как калий (K), натрий (Na) и литий (Li), имеют различные степени окисления в химических соединениях. Степень окисления определяет количество электронов, которые атом азота или металла получает или отдает при формировании соединения.
В соединениях с активными металлами, азот чаще всего имеет степень окисления -3. Например, в соединении азотида калия (KN), атом азота получает три электрона от атома калия, чтобы достичь октетного электронного состояния.
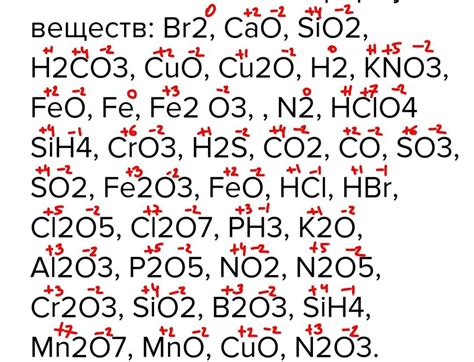
С другой стороны, в некоторых более сложных соединениях, азот может иметь более высокую степень окисления. Например, в нитратах типа KNO3 или NaNO3, азот имеет степень окисления +5. В этих соединениях азот отдает пять электронов, чтобы образовать катионы NO3-.
Следует отметить, что степень окисления азота может варьироваться в зависимости от условий реакции и окружающей среды. Например, при наличии кислорода азот может иметь степень окисления +2, как в соединении N2O, известном как азотистый оксид или смилакс.
Таким образом, степень окисления азота и активных металлов зависит от типа соединения и реакционных условий, и она играет важную роль в химических свойствах и реакционных механизмах этих веществ.
Определение степени окисления

Степень окисления элемента вещества - это числовое значение, которое показывает, сколько электронов элемент отдает или принимает при реакции. Она характеризует химическое состояние элемента в соединении.
Определение степени окисления вещества является важным шагом в анализе химической реакции. Степень окисления помогает определить формулу вещества и способствует пониманию механизма химической реакции.
Степень окисления определяется с помощью нескольких правил, которые отражают изменение в распределении электронов при образовании химической связи. Степень окисления подразумевает наличие положительного или отрицательного знака перед числовым значением.
Определение степени окисления включает в себя рассмотрение электроотрицательности элемента, его расположения в периодической системе, а также учет знака заряда на ионе или знака элементарного заряда.
Определение степени окисления позволяет более полно понять реакцию, понять какие элементы участвуют в окислении, а какие восстановлении, и дает возможность проведения более точных расчетов в химических уравнениях.
Свойства азота

Двуатомный элемент: азот представляет собой безцветный газ, состоящий из двух атомов, обозначается символом N и имеет атомный номер 7 в периодической системе элементов.
Положение в природе: азот является одним из наиболее распространенных элементов в природе. Он входит в состав воздуха на уровне около 78% по объему и около 75% по массе. Также азот содержится в почве, водах и живых организмах.
Химические свойства: азот является инертным газом и не реагирует с большинством веществ при комнатной температуре и давлении. Однако при высоких температурах и в присутствии активных металлов, азот образует с ними соединения.
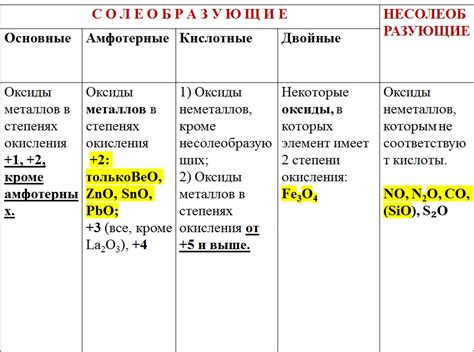
Окислительные свойства: азот обладает окислительными свойствами и может выступать в реакциях окислителем или восстановителем в зависимости от степени окисления. Например, в соединениях с положительными степенями окисления (+3, +4, +5) азот выступает в роли окислителя, а в соединениях с отрицательными степенями окисления (-3, -2, -1) – в роли восстановителя.
Применение: азот имеет широкое применение в различных областях. Он используется для производства удобрений, пищевой и химической промышленности, в процессах замораживания и сушки, а также в космических исследованиях.
Свойства активных металлов

Активные металлы - это элементы, которые легко взаимодействуют с другими веществами, образуя соединения и проявляя химическую активность. Они характеризуются высокой реакционной способностью и сильным восстановительным действием.
Одно из главных свойств активных металлов - способность образовывать ионы с положительным зарядом. Они легко отдают электроны, что позволяет им вступать в реакции окисления. Благодаря своей химической активности, активные металлы широко используются в различных процессах и технологиях.
Важным свойством активных металлов является их способность растворяться в кислотах. При этом происходит образование солей и выделение водорода. Например, натрий реагирует с соляной кислотой, образуя хлорид натрия и выделяя водород. Это свойство может использоваться для получения водорода.
Взаимодействие активных металлов с веществами, содержащими кислород, также является одним из их характерных свойств. Например, натрий взаимодействует с водой, образуя гидроксид натрия и выделяя водород. Это реакция иллюстрирует способность активных металлов вступать в реакции с водой.
Активные металлы также обладают способностью образовывать сплавы с другими металлами. Это позволяет им улучшать механические и электрические свойства полученных сплавов. Например, цинк часто используется в сплавах с другими металлами для защиты их от коррозии.
В целом, активные металлы имеют широкий спектр свойств, который делает их важными компонентами в различных областях науки и промышленности. Их химическая активность и способность образовывать различные соединения делает их неотъемлемой частью современной химии и материаловедения.
Взаимодействие азота и активных металлов
Азот и активные металлы проявляют взаимодействие при создании ряда соединений, которые имеют важное значение в различных областях химии и промышленности.
Одной из наиболее известных реакций взаимодействия азота и активных металлов является образование азида металла. Азиды обладают высокой степенью окисления азота, что делает их взрывоопасными соединениями. Они находят применение в производстве пиротехнических смесей, а также используются в качестве составных частей взрывчатых веществ.
Интересным результатом взаимодействия азота и активных металлов является образование азотидов, содержащих ионы N3-. Азотиды обладают аналогичной степенью окисления азота, как и азиды, однако они могут образовывать более устойчивые и стабильные соединения.
Другим примером взаимодействия азота и активных металлов является образование амидов и нитридов. Амиды содержат ионы N2-, а нитриды - ионы N3-. Эти соединения используются в качестве катализаторов в различных химических реакциях, а также в производстве удобрений и пигментов.
Таким образом, взаимодействие азота и активных металлов приводит к образованию различных соединений, которые могут быть использованы в различных областях химии и промышленности. Эти соединения обладают важными свойствами и находят широкое применение в нашей жизни.
Формирование равенства степени окисления
Равенство степени окисления между атомами азота и активными металлами обусловлено особенностями электронной структуры и химических свойств данных элементов.
В химических соединениях, где азот образует связь с активными металлами, атом азота устанавливает положительную степень окисления, а активный металл — отрицательную степень окисления.
Например, в соединении аммиак (NH3) атом азота обладает степенью окисления -3, так как атом азота делит восемь электронов со связью с тремя атомами водорода, образуя четыре связи. Атомы водорода образуют связи с атомом азота и устанавливают степень окисления +1.
Таким образом, общая сумма степеней окисления в аммиаке равна нулю, что указывает на равенство степени окисления азота и активных металлов.
Равенство степени окисления в соединениях азота с активными металлами позволяет предсказывать химические свойства данных соединений и использовать их в различных областях, таких как промышленность и медицина.
Примеры реакций

Азот и активные металлы могут вступать в различные реакции, при которых меняется степень окисления азота. Наиболее известными примерами таких реакций являются:
- Образование нитридов: Активные металлы, такие как литий (Li), натрий (Na), калий (K) и др., могут реагировать с азотом (N2) и образовывать нитриды, например, Li3N, Na3N, KN3 и др. В этих реакциях азот переходит из молекулярного состояния к ионному состоянию с окислением степени N2 до -3.
- Образование азидов: Азиды - соединения, содержащие ион азида (N3-), также являются продуктом реакции активных металлов с азотом. Например, реакцией натрия с азотом образуется натриевый азид (NaN3), который широко используется в пиротехнике и как компонент взрывчатых веществ. В этих реакциях степень окисления азота также составляет -3.
- Образование оксида азота: Активные металлы могут также окислять азот до более высоких степеней окисления. Например, калий может реагировать с азотной кислотой (HNO3) и образовывать оксид азота (NO) с окислением степени азота до +2. Оксид азота является одним из важных промышленных продуктов и используется в производстве азотной кислоты, пластмасс и других соединений.
Это лишь несколько примеров реакций азота с активными металлами, и их число намного больше. Все эти реакции позволяют использовать азот и активные металлы в различных областях, таких как химическая промышленность, сельское хозяйство и медицина.
Практическое значение

Равенство степени окисления в соединениях азота и активных металлов имеет важное практическое значение в различных областях науки и техники.
В химическом анализе равенство степени окисления позволяет определить концентрацию и состав различных соединений. Например, оно используется при анализе почвы и воды, позволяя оценить их загрязненность и определить наличие или отсутствие определенных веществ.
В промышленности равенство степени окисления помогает улучшить производственные процессы и создать более эффективные катализаторы. Азотные оксиды, например, являются важными промышленными продуктами, которые используются в производстве кислот, удобрений и других химических соединений.
В электрохимии равенство степени окисления позволяет понять и контролировать протекание электрохимических реакций. Это важно при проектировании и создании электрохимических устройств, таких как аккумуляторы и гальванические элементы.
Кроме того, понимание равенства степени окисления в соединениях азота и активных металлов помогает в разработке новых материалов с уникальными свойствами. Это может быть полезно в различных областях, включая металлургию, электронику и фотонику.
Вопрос-ответ

Зачем активным металлам нужен азот?
Азот является необходимым компонентом для многих химических процессов, в которых участвуют активные металлы. Он может служить как окислителем, так и веществом, с которым происходят реакции образования соединений. Также азот может участвовать в образовании комплексных соединений с активными металлами.
Какие реакции между азотом и активными металлами известны?
Существует множество реакций между азотом и активными металлами. Одной из наиболее известных является реакция образования азотида. В этой реакции азот реагирует с активным металлом, образуя азид и гидрид металла. Также известны реакции образования нитридов и комплексных соединений с участием азота и активных металлов.
