Сгорание металла – это процесс, при котором металл соединяется с кислородом воздуха в результате выделения тепла и света. В результате данного процесса образуется оксид металла. Оксид – это соединение металла с кислородом, которое имеет характерные свойства и состав.
Каждый металл может образовывать свой оксид при сгорании. Например, при сгорании железа образуется оксид железа (FeO), при сгорании алюминия – оксид алюминия (Al2O3), при сгорании магния – оксид магния (MgO) и так далее. Оксиды металлов могут иметь различные степени окисления и состав, что зависит от условий сгорания и конкретного металла.
Оксиды металлов имеют важное значение в химической промышленности и в ежедневной жизни. Некоторые из них широко используются в производстве металлов, стекла, электронных компонентов и других материалов, а также в процессе окраски и консервации металлических изделий.
Таким образом, при сгорании металла образуется оксид, который зависит от вида металла и условий сгорания. Оксид металла является важным химическим соединением, которое имеет широкое применение в различных отраслях промышленности и жизни.
Оксиды при сгорании металла

Сгорание металлов является ярким процессом, в результате которого образуются различные оксиды. Оксиды металлов – это химические соединения, состоящие из металлического элемента и кислорода. При сгорании металла, образование оксида происходит благодаря реакции металла с кислородом из воздуха.
Оксиды металлов имеют важное значение в химии и применяются в различных областях. Они могут быть как кислотными, так и основными в своей природе. В зависимости от химической активности и электрохимического потенциала металла, образующийся оксид может иметь разную окислительную способность.
Одним из известных примеров оксида, образующегося при сгорании металла, является оксид железа (III) – Fe2O3. Этот оксид образуется при сгорании железа на воздухе и находит широкое применение в производстве стали, красок и многочисленных других материалов.
Кроме Fe2O3, сгорание других металлов может приводить к образованию таких оксидов, как CuO, ZnO, Al2O3 и др. Каждый из них имеет свои особенности, связанные с химическими и физическими свойствами металла.
Таким образом, сгорание металла приводит к образованию различных оксидов, которые имеют важное значение в химии и используются в разных сферах жизни. Понимание процесса образования оксидов позволяет более глубоко изучать химические свойства металлов и их взаимодействие с другими веществами.
Сгорание металла

Сгорание металла - это химический процесс окисления, при котором металл реагирует с кислородом из воздуха, образуя оксид металла. В результате сгорания металла образуется твердый продукт - оксид, который может иметь различные свойства и использоваться в различных областях промышленности и научных исследований.
Сгорание металла происходит при высоких температурах, когда между металлом и кислородом происходит реакция. В результате этой реакции образуется богатый кислородом оксид металла, который может быть как твердым, так и газообразным.
Примером сгорания металла является сжигание металлического стрежня или электрической проволоки. При сжигании черного стрежня образуется оксид железа (III), который имеет красно-коричневый цвет и называется ржавчиной. При сжигании медной проволоки образуется оксид меди (II), который имеет зеленовато-синий цвет и называется медью оксидом или купритом.
Сгорание металла является важным процессом, так как позволяет получать новые соединения и изучать их свойства. Оксиды металлов широко используются в производстве красок, электроники, керамики и других отраслях промышленности. Кроме того, сгорание металла является важным элементом в химическом анализе и исследованиях свойств различных веществ.
Процесс образования оксида

Оксиды представляют собой соединения металлов с кислородом. Они образуются при сгорании металлов в результате их реакции с кислородом воздуха.
Процесс образования оксида является результатом окисления металла. При сгорании металла в присутствии кислорода, его атомы соединяются с кислородом и образуют стабильные оксидные соединения. Эти соединения имеют важное значение в различных процессах и применяются в разных областях, таких как металлургия и химическая промышленность.
Образование оксида является быстрым процессом, обычно сопровождающимся выделением тепла и света. Реакция между металлом и кислородом протекает при высоких температурах и требует наличия кислорода в воздухе.
Реакция окисления металла может происходить по-разному в зависимости от свойств металла. Некоторые металлы легко окисляются и образуют стабильные оксиды, такие как оксид железа (Fe2O3), оксид алюминия (Al2O3) и оксид меди (CuO). Другие металлы, такие как золото и платина, имеют низкую склонность к окислению и не образуют стабильные оксиды при сгорании.
В результате образования оксида металла меняется его химический состав и свойства. Оксиды металлов могут быть использованы в различных отраслях промышленности, а также в процессе производства различных материалов, включая металлические сплавы, керамику и стекло.
Каков состав оксида?

Оксид, образующийся при сгорании металла, имеет определенный химический состав. В состав оксида входит сам металл и кислород.
Например, если сгорает металлический кальций, то образуется оксид кальция (CaO), который состоит из одной части кальция и одной части кислорода. С другими металлами, такими как алюминий, железо, медь и т.д., образуются соответствующие оксиды, состоящие из атомов металла и атомов кислорода в определенных пропорциях.
Состав оксида зависит от химических свойств металла и условий его сгорания. Некоторые металлы могут образовывать несколько оксидов, в зависимости от температуры, окружающей среды и других факторов.
Знание состава оксида и его свойств позволяет проводить определенные химические реакции и применять оксиды металлов в различных сферах, например, в производстве стекла, керамики, цемента и других материалов.
Примеры оксидов при сгорании разных металлов
Сгорание металлов является химической реакцией, которая приводит к образованию оксидов. Оксиды металлов являются химическими соединениями, состоящими из металлического и кислородного атомов. В процессе сгорания различных металлов образуются разные оксиды.
Например, при сгорании железа образуется оксид железа (III), также известный как гематит. Он имеет формулу Fe2O3 и является красным порошком. Этот оксид широко используется в производстве красок и пигментов.
Алюминий сгорает в кислороде и образует оксид алюминия, известный как алюминиевая зола или белила. Его формула - Al2O3. Этот оксид обладает высокой термической стабильностью и используется в качестве сырья для производства алюминия и в строительной отрасли.
Медь, сгорая в кислороде, образует оксид меди, известный как медный оксид или купрат. Его формула - CuO. Этот оксид имеет черный цвет и применяется в производстве красок и пигментов, а также в качестве смазочных материалов.
Таким образом, сгорание металлов приводит к образованию разнообразных оксидов, которые имеют разные свойства и применяются в различных отраслях промышленности и науки.
Физические свойства оксида

Оксид - это химическое соединение, образующееся при сгорании металла с кислородом. Каждый металл образует свой характерный оксид. Физические свойства оксида зависят от свойств образующего его металла.
Цвет оксида может быть различным и зависит от металла. Например, оксид железа (III) имеет красный цвет, оксид меди (II) - зеленый, оксид алюминия - белый и т.д. Цвет оксида определяется электронной структурой и энергетическими уровнями атомов вещества.
Плотность оксидов также может значительно отличаться. Некоторые оксиды, например оксид алюминия, обладают невысокой плотностью, а другие, например оксид свинца, - высокой.
Растворимость оксидов зависит от взаимодействия с веществами, растворяющими их. Некоторые оксиды, например оксид натрия, растворяются в воде и образуют щелочные растворы. Другие оксиды, например оксид серы, не растворяются в воде и образуют кислотные растворы.
Температурная устойчивость оксидов может варьироваться в зависимости от металла. Некоторые оксиды выдерживают высокие температуры без разложения, а другие могут разлагаться или проявлять другие физические изменения при нагревании.
Электропроводность оксидов может быть различной. Некоторые оксиды, например оксид алюминия, обладают низкой электропроводностью, а другие, например оксиды металлов первой группы, могут проводить электрический ток. Электропроводность оксидов зависит от наличия свободных электронов или ионов в их структуре.
Химические свойства оксида

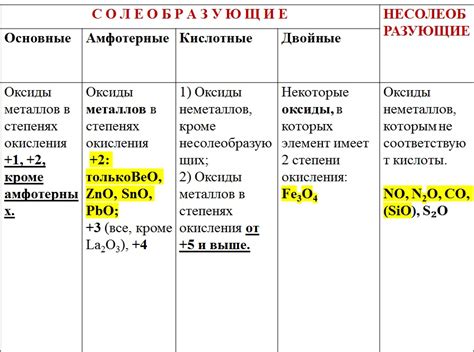
Оксид – химическое соединение, образующееся при сгорании металла. Химические свойства оксида зависят от типа металла, который претерпевает окисление. Наиболее распространенными оксидами металлов являются оксиды двух типов: основные и амфотерные.
Основные оксиды образуются при сгорании щелочных и щелочноземельных металлов. Они обладают высокой щелочностью и легко растворяются в воде, образуя гидроксиды. Щелочные оксиды в реакции с кислотами образуют соли и воду.
Амфотерные оксиды образуются при сгорании металлов серии блоков d и блоков f. Они обладают как основными, так и кислотными свойствами. В зависимости от условий реакции амфотерные оксиды могут проявлять свои основные или кислотные свойства. Например, оксид железа может взаимодействовать и с кислотами, и с щелочами.
Оксиды также проявляют свои кислотные или основные свойства в реакциях с водой. Кислотные оксиды взаимодействуют с водой, образуя кислоты, а основные оксиды взаимодействуют с водой, образуя щелочи.
Вопрос-ответ

Какие оксиды образуются при сгорании металлов?
При сгорании металлов может образовываться разнообразные оксиды. Например, при сгорании железа образуется двуокись железа (Fe2O3), при сгорании меди - оксид меди (CuO), при сгорании свинца - оксид свинца (PbO) и т. д.
Какие оксиды образуются при сгорании алюминия и цинка?
При сгорании алюминия образуется оксид алюминия (Al2O3), а при сгорании цинка - оксид цинка (ZnO).
