Нитраты - соли, состоящие из иона нитрата (NO3-), и источником целого ряда катионов металлов. Нитраты металлов часто используются в промышленности и лабораторных условиях для различных целей. Одним из наиболее распространенных нитратов является нитрат цинка (Zn(NO3)2), который используется в различных отраслях промышленности, включая гальваническую, фармацевтическую и косметическую.
Металлический нитрат цинка может быть получен путем разложения соответствующего нитрата при определенных условиях. Для получения нитрата цинка часто используют нитрат цинка гексагидрат (Zn(NO3)2·6H2O), который является наиболее распространенным коммерческим источником вещества. Разложение нитрата цинка гексагидрата происходит с образованием металлического нитрата цинка и выделением молекул воды.
Знание процесса разложения нитратов и образования металл нитратов важно для понимания и использования этих соединений в различных областях науки и промышленности.
Разложение нитрата цинка гексагидрата можно провести нагреванием в атмосфере воздуха или при применении окислителей. В процессе разложения образуется металлический нитрат цинка и выделяется молекула воды. Разложение может быть описано химическим уравнением:
Zn(NO3)2·6H2O → Zn(NO3)2 + 6H2O
Таким образом, при разложении нитрата цинка гексагидрата образуется металл нитрат цинка и молекулы воды, что делает его важным источником нитрата цинка в различных процессах и применениях.
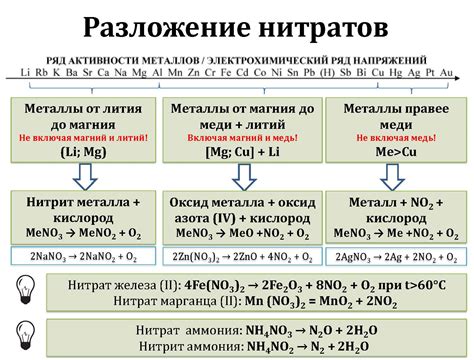
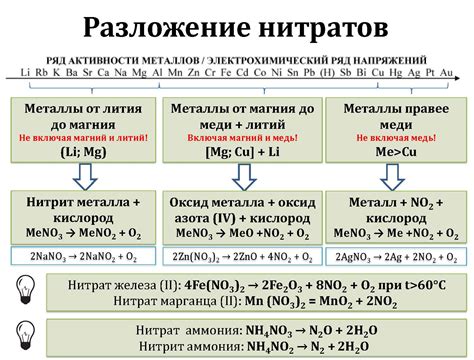
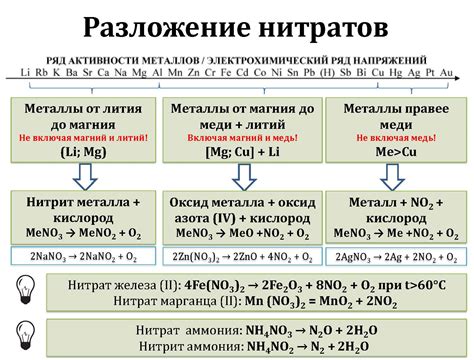
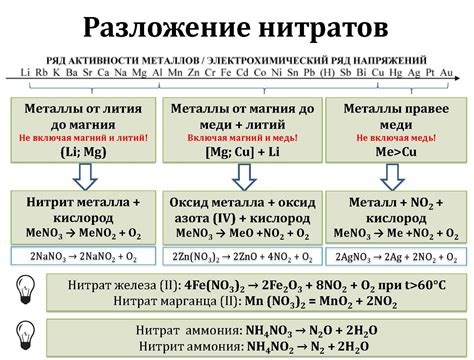
Разложение нитратов

Нитраты - это соли, состоящие из аниона нитрата (NO3-) и катиона металла. Под воздействием различных факторов, таких как тепло, свет, кислоты или электрический ток, нитраты могут разлагаться на элементарный металл и газообразные продукты.
Разложение нитратов является одним из видов химических реакций, которые использовались человеком задолго до открытия и изучения принципов химии. Например, разложение нитрата калия было широко применялось в производстве порошка для огнестрельного оружия.
Разложение нитратов происходит с выделением газообразных продуктов. Например, при разложении нитрата калия (KNO3) образуются оксид азота (NO2) и кислород (O2).
| Нитрат | Продукты разложения |
|---|---|
| Нитрат калия (KNO3) | Оксид азота (NO2) и кислород (O2) |
| Нитрат меди (Cu(NO3)2) | Оксид азота (NO2) и оксид меди (CuO) |
| Нитрат свинца (Pb(NO3)2) | Оксид азота (NO2) и оксид свинца (PbO) |
Разложение нитратов может быть использовано для получения металлов из их соединений. Например, при разложении нитрата цинка (Zn(NO3)2) образуется металл нитрат цинка (ZnO) и оксид азота (NO2).
Важно отметить, что разложение нитратов может протекать с выделением энергии в виде тепла или света. Такие реакции могут быть опасными и требуют соблюдения мер предосторожности при проведении в лабораторных условиях.
В целом, разложение нитратов представляет собой химическую реакцию, которая может привести к образованию металлов и газообразных продуктов. Эта реакция может иметь широкий спектр применений, от производства порошка до получения чистых металлов.
Металл нитрат цинка
Металл нитрат цинка - это химическое соединение, получаемое при разложении нитратов цинка. Он представляет собой соль, образованную металлическим элементом цинком и нитратными ионами. Металл нитрат цинка обладает особыми свойствами и широко применяется в различных отраслях промышленности и научных исследованиях.
Металл нитрат цинка имеет химическую формулу Zn(NO3)2 и молекулярную массу около 189,38 г/моль. Он обычно выглядит как белый кристаллический порошок или гранулы. Металл нитрат цинка хорошо растворим в воде, образуя нитратную кислоту и гидроксид цинка.
Металл нитрат цинка часто используется в гальваническом производстве и электрохимии. Он является хорошим окислителем и может быть использован в процессах электролиза и электроосаждения. Кроме того, металл нитрат цинка применяется в производстве пигментов, вчувствительных элементов фотоэлементов и других электронных устройств.
Металл нитрат цинка также широко используется в качестве промышленного катализатора, особенно в химической и нефтеперерабатывающей промышленности. Он может способствовать различным химическим реакциям и повышать эффективность процессов превращения веществ.
Образование металл нитрат цинка
Металл нитрат цинка образуется при разложении нитратов цинка. Нитраты цинка представляют собой соединения цинка и нитратной кислоты, общая формула которых Zn(NO3)2. При нагревании нитратов цинка происходит их разложение на оксид цинка (ZnO), газовые продукты и нитратные остатки.
Реакция разложения нитратов цинка протекает по следующему уравнению:
2Zn(NO3)2 → 2ZnO + 4NO2 + O2
Оксид цинка (ZnO) образует при этом темно-желтую или белую пыль, газовые продукты включают двуокись азота (NO2) и кислород (O2), а нитратные остатки - ионы нитрата (NO3-).
Образование металл нитрата цинка происходит из-за термического разложения нитратов цинка и представляет собой одну из реакций, используемых в химических лабораториях для получения нитратов металлов. При этом металл нитрат цинка может использоваться в качестве реагента, катализатора или компонента при синтезе различных химических соединений.
Нитраты, разложение которых образует металл нитрат цинка
Металл нитрат цинка может быть образован при разложении некоторых нитратов веществ. Разложение нитратов - это химический процесс, в результате которого происходит распад соединения с образованием различных продуктов.
Нитраты - это соли азотистой кислоты, содержащие ион азотата (NO3-). Разложение нитратов может происходить при нагревании или взаимодействии со сильными окислителями. В результате такого разложения образуются различные продукты, включая металл нитрат цинка.
Примерами нитратов, разложение которых образует металл нитрат цинка, являются:
- Нитрат цинка (Zn(NO3)2) - при нагревании нитрата цинка, он разлагается на оксид цинка и оксид азота. В результате взаимодействия с водой образуется металлический нитрат цинка.
- Нитрат аммония (NH4NO3) - этот нитрат распадается при нагревании на оксид азота и воду. При взаимодействии оксида азота с водой образуется металл нитрат цинка.
- Нитрат свинца (Pb(NO3)2) - при нагревании нитрата свинца он разлагается на оксид свинца и оксид азота. В результате реакции с водой образуется металл нитрат цинка.
Разложение этих нитратов может быть использовано в различных химических процессах и реакциях, а металл нитрат цинка может быть использован, например, в производстве красителей, жидкостей для охлаждения и в электронике.
Применение металл нитрата цинка

Металл нитрат цинка, полученный при разложении нитратов цинка, находит широкое применение в различных сферах деятельности. В первую очередь, его используют в химической промышленности. Он является исходным материалом для производства других нитратов цинка, а также для получения различных соединений цинка, которые находят применение в катализе и производстве пигментов.
Металл нитрат цинка также применяется в фармацевтической промышленности. Он является важным компонентом при производстве лекарственных препаратов, которые используются для лечения заболеваний кожи и глаз, а также вмешательств на сердечно-сосудистой системе.
Кроме того, металл нитрат цинка находит применение в производстве различных средств защиты от коррозии. Он используется для создания антикоррозионных покрытий на металлических поверхностях, таких как трубы и конструкции, подверженные воздействию влаги и агрессивных сред.
Также следует отметить, что металл нитрат цинка используется в электротехнике и электронике. Он является компонентом электролитических растворов, которые используются для создания гальванических покрытий и проведения электрохимических процессов.
В итоге, металл нитрат цинка является важным и универсальным химическим соединением, которое находит применение в различных отраслях промышленности и играет важную роль в создании новых материалов и технологий.
Получение металл нитрат цинка
Металл нитрат цинка можно получить путем разложения нитрата цинка, который является химическим соединением состоящим из атомов цинка и группы нитрат.
Разложение нитрата цинка происходит при нагревании, при этом в результате реакции выделяется азотная кислота и образуется металл нитрат цинка. Температура, при которой происходит разложение, зависит от конкретного соединения нитрата цинка и может варьироваться.
Разложение нитрата цинка можно представить в виде химического уравнения:
- Нитрат цинка (Zn(NO3)2) -- температура --> Азотная кислота (HNO3) + Металл нитрат цинка (Zn(NO3)2)
Полученный металл нитрат цинка можно использовать в различных областях, например в химическом производстве или в лабораторных исследованиях. Он может быть использован как катализатор при проведении реакций, а также в качестве ионного и молекулярного растворителя при получении других химических соединений.
Важно отметить, что разложение нитрата цинка и получение металл нитрат цинка является химическим процессом, который требует специальных условий и осторожности. При работе с этим веществом необходимо соблюдать меры безопасности, применять защитные средства и проводить эксперименты в хорошо проветриваемом помещении или под вытяжным шкафом.
Вопрос-ответ

Почему при разложении нитрата цинка образуется металл нитрат?
При разложении нитрата цинка происходит распад соединения на металлический цинк и нитратный ангидрид. Таким образом, образуется металл нитрат цинка.
Каковы условия разложения нитратов, при которых образуется металл нитрат цинка?
Для разложения нитрата цинка и получения металла нитрата необходимо нагреть соединение до определенной температуры. Обычно это происходит при нагревании до 500-600 градусов Цельсия. При таких условиях нитрат цинка разлагается, образуя металл нитрат цинка.
Какие применения может иметь металл нитрат цинка, получаемый при разложении нитратов?
Металл нитрат цинка имеет широкое применение в различных отраслях промышленности. Например, его можно использовать в процессе электроосаждения цинка на поверхность металлических изделий, а также в производстве батарей, сплавов и других материалов. Кроме того, металл нитрат цинка может быть использован в качестве катализатора в химических реакциях.
