Разложение нитратов - это процесс, при котором нитратные соединения распадаются на металл и кислород. Он имеет большое значение в химии и применяется в различных областях, включая производство металлов.
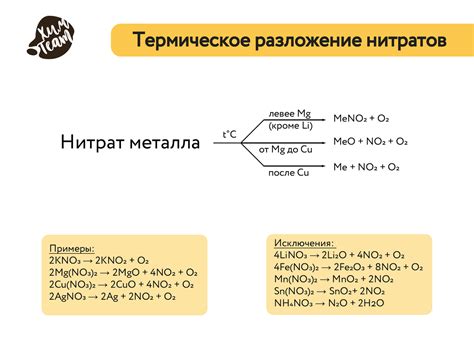
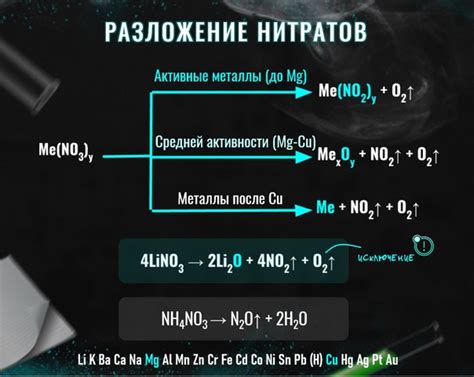
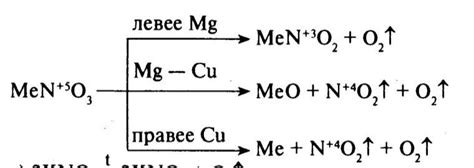
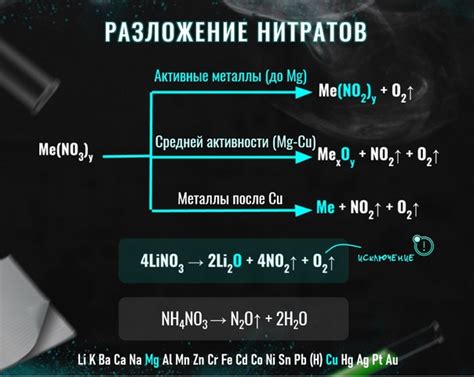
Один из наиболее распространенных способов разложения нитратов - это термическое разложение. Под воздействием высокой температуры нитратные соединения распадаются на оксиды металлов и кислород. Например, при нагревании нитрата свинца (Pb(NO3)2 ) он распадается на оксид свинца (PbO) и кислород.
Термическое разложение нитратов также применяется в процессе получения атомного кислорода. Для этого используют нитрат калия (KNO3), который при нагревании разлагается на кислород и нитрит калия (KNO2).
Однако, не все нитраты могут быть разложены термическим путем для получения металлов. Некоторые нитраты, такие как нитраты золота или платины, очень стабильны и не могут быть разложены даже при очень высоких температурах. Для получения металлов из таких нитратов применяют другие методы, такие как электролиз или химические реакции с другими веществами.
Нитраты и разложение

Нитраты - это соли, которые содержат отрицательно заряженные нитратные ионы (NO3-). Они широко используются в промышленности и научных исследованиях благодаря своим химическим свойствам.
Разложение нитратов - это процесс, при котором нитратные ионы распадаются на элементарные компоненты, что может включать в себя выделение кислорода и образование соответствующих окислительных или восстановительных продуктов.
Разложение нитратов может происходить под действием высокой температуры, катализаторов или других химических веществ. К примеру, при нагревании нитрата кальция (Ca(NO3)2) он распадается на оксид кальция (CaO), выделяя кислород. Также, нитрат меди (Cu(NO3)2) может разлагаться при нагревании, образуя окись меди (CuO) и выделяя кислород.
Разложение нитратов играет важную роль в различных процессах, включая промышленное производство, применение в пиротехнике, а также в химических исследованиях и экспериментах. Изучение химических реакций разложения нитратов позволяет получить новые вещества, исследовать их свойства и применение в различных отраслях науки и промышленности.
Металлические нитраты
Нитраты металлов – это соли, которые образуются при взаимодействии кислоты и соответствующего металла. Они широко применяются в различных отраслях промышленности и научных исследованиях. Для получения металлического нитрата необходимо провести процесс разложения соответствующего нитрата.
Одним из наиболее распространенных металлических нитратов является нитрат натрия. При его разложении получается чистый металл натрий. Реакция разложения нитрата натрия происходит при нагревании и сопровождается выделением кислорода. Такой процесс используется для получения натрия из нитрата натрия в промышленных масштабах.
Важно отметить, что разложение нитратов восстанавливает металл из его соединения с кислородом. Например, металлический нитрат меди (II) – это соль, в которой медь находится в окислительном состоянии. При разложении этого нитрата возникает окислительно-восстановительная реакция, в результате которой медь восстанавливается и образуется нитрат кислорода.
Металлические нитраты имеют важное значение в химической промышленности и научных исследованиях. Они используются в процессе получения металлов и их соединений, а также в качестве катализаторов и окислителей. Разложение нитратов – один из способов получения металлических элементов и прекурсоров для дальнейшей химической обработки.
Разложение нитратов

Нитраты - это соли, которые включают в себя анион нитрата (NO3-). Нитраты обладают высокой реакционной способностью и могут разлагаться под воздействием различных факторов, включая тепло, свет и другие химические вещества.
Разложение нитратов происходит в результате окисления аниона нитрата. Обычно разложение происходит при нагревании нитратов, что приводит к выделению кислорода и образованию соответствующего оксида металла.
Например, разложение нитрата меди (Cu(NO3)2) при нагревании приводит к образованию оксида меди (CuO) и выделению кислорода (O2):
- 2Cu(NO3)2 -> 2CuO + 4NO2 + O2
Аналогично, разложение нитрата железа (Fe(NO3)3) при нагревании приводит к образованию оксида железа (Fe2O3) и выделению кислорода (O2):
- 2Fe(NO3)3 -> 2Fe2O3 + 6NO2 + 3O2
Таким образом, разложение нитратов позволяет получить оксиды металлов. Это является важной химической реакцией, которая широко используется в промышленности и лабораторных исследованиях для получения различных продуктов.
Применение полученных металлов

Полученные металлы из нитратов имеют разнообразные применения в различных отраслях промышленности и научных исследованиях. Некоторые из них могут использоваться в качестве конструкционных материалов, благодаря своей прочности и устойчивости к коррозии.
Например, полученный металл из нитрата железа (Fe(NO3)2) может быть использован для производства стальных конструкций, автомобильных деталей, а также для создания инструментов и оборудования в машиностроении.
Металл, полученный из нитрата меди (Cu(NO3)2), имеет широкое применение в электронике и электротехнике. Он используется для создания проводников, контактов и различных электрических компонентов.
Некоторые металлы, полученные из нитратов, находят применение в производстве катализаторов и красителей для текстильной промышленности. Они обладают специальными свойствами, которые позволяют улучшить процессы окрашивания и снизить негативное воздействие на окружающую среду.
Также металлы, полученные из нитратов, могут использоваться как активные компоненты в различных химических реакциях. Они используются в качестве катализаторов для ускорения химических процессов или в качестве основных реагентов при синтезе различных органических соединений.
Вопрос-ответ

Какой металл получается при разложении нитрата калия?
При разложении нитрата калия на нитрат и кислород получается металл - калий.
Какие металлы образуются при разложении нитрата аммония?
При разложении нитрата аммония образуются металлы - аммиак и водород.
При разложении какого нитрата получается железо?
При разложении нитрата железа на оксид и кислород получается металл - железо.