Возникающие явления при контактировании двух разных металлов являются важной областью исследований в области физики и химии. При взаимодействии двух различных металлических материалов происходят разнообразные физические и химические процессы, которые влияют на электрические и механические свойства материалов.
Одним из наиболее известных явлений при контактировании двух разных металлов является электрохимическая коррозия. При этом процессе происходит перенос электронов из одного металла на другой, который приводит к образованию гальванической пары. В результате такого взаимодействия происходит растворение одного из металлов, что может вызывать разрушение или потерю электрических свойств вещества.
Кроме того, при контактировании двух различных металлов может происходить образование интерметаллических соединений. Это явление возникает в результате взаимодействия различных атомов в межметаллическом соединении и может приводить к образованию химически стойких компонент. Такое соединение может иметь различные механические свойства и степень устойчивости к внешним воздействиям.
Исследование явлений при контактировании двух различных металлов имеет важное практическое значение. Это позволяет разрабатывать новые сплавы, повышать устойчивость различных конструкций и улучшать электрические свойства материалов. Кроме того, понимание этих явлений помогает предотвращать коррозию и разрушение материалов, что важно для создания долговечных и надежных изделий.
Явления при контактировании различных металлов

Контактирование различных металлов может вызывать различные явления, такие как коррозия, гальваническая пара и электролиз.
Коррозия – это процесс разрушения металла под воздействием окружающей среды. При контактировании различных металлов, когда они находятся в электролитической среде, может возникать гальваническая коррозия. Это происходит из-за разности потенциалов между металлами, что приводит к течению электрического тока и разрушению материала.
Гальваническая пара возникает при контактировании двух различных металлов в присутствии электролита, такого как вода или соленое раствор. Этот процесс основан на разности потенциалов между металлами: один металл становится анодом, а другой - катодом. Такое взаимодействие может приводить к электрохимическим реакциям и образованию электрического тока.
Электролиз – это процесс, который может возникать при контактировании двух различных металлов в присутствии электролитической среды и внешнего электрического тока. В этом случае один металл участвует в анодной реакции, а другой – в катодной. Электролитический потенциал позволяет контролировать направление течения электролиза.
Гальваническая коррозия
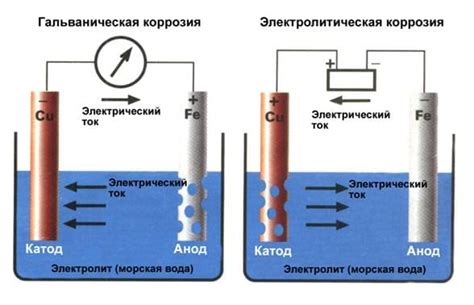
Гальваническая коррозия – явление разрушения металлических поверхностей, возникающее при контактировании двух разных металлов в присутствии электролита. Одно из металлов, называемое активным, вступает в химическую реакцию с электролитом, а другое металл, называемое недостаточно активным, остается инертным.
Процесс гальванической коррозии основан на разности потенциалов между металлами. Активный металл становится анодом, теряет электроны и растворяется в электролите. Недостаточно активный металл исполняет роль катода, принимает электроны и остается инактивным. Электролит служит проводником для передачи электрического тока между металлами.
Существует несколько факторов, влияющих на интенсивность гальванической коррозии. Одним из них является разница электрохимических потенциалов металлов. Чем больше эта разница, тем более активен металл и тем интенсивнее протекает коррозия. Влияние на коррозию оказывает также концентрация электролита и его состав, температура, наличие примесей и др.
Примером гальванической коррозии может служить коррозия цинка, которая используется для защиты железа от окисления. При контактировании цинка с железом в присутствии влаги возникает гальваническая пара, где цинк служит анодом, а железо – катодом. Это позволяет защитить железо от коррозии, так как цинк растворяется вместо него.
Образование гальванопары

Гальванопара, также известная как гальваническая пара, является электрохимической системой, которая образуется при контактировании двух разных металлов. Она возникает благодаря различным электрохимическим свойствам этих металлов.
Образование гальванопары происходит при соединении двух металлов в электролите, таком как вода или соль. Один из металлов называется анодом, а другой - катодом. Анод обладает отрицательным потенциалом, в то время как катод имеет положительный потенциал.
При контактировании между собой анода и катода, образуется гальваническая реакция. Конкретные химические реакции зависят от металлов, которые образуют гальванопару. В результате этой реакции происходит передача электронов через электролит от анода к катоду. Это движение электронов создает электрический ток, который может быть использован для различных целей, например, для приведения в действие электрической цепи.
Образование гальванопары имеет множество практических применений. Оно является основой для работы различных батарей, элементов питания, аккумуляторов и других устройств, которые используют электрический ток.
Электролитическое осаждение

Электролитическое осаждение является одним из методов обработки поверхности металла, при котором на его поверхности происходит формирование покрытия из другого металла. Данный процесс осуществляется в электролитической ванне, где металл, который является основной деталью, выступает в качестве анода.
Процесс электролитического осаждения возможен благодаря проведению электрического тока через электролит, который содержит растворенные ионы металла, из которого формируется покрытие. При этом на катоде (поверхности металла) происходит образование и накопление металлического покрытия.
- Применение электролитического осаждения позволяет получить покрытие с заданными характеристиками, такими как толщина, структура, прочность.
- Данный метод широко применяется в различных сферах промышленности, включая автомобильную, аэрокосмическую и электронную промышленности.
- Часто электролитическое осаждение используется для защиты деталей от коррозии, а также для придания им декоративных свойств.
В ходе процесса электролитического осаждения важную роль играют такие параметры, как температура раствора, плотность тока, состав электролита. Вариация этих параметров может влиять на конечные характеристики получаемого покрытия.
| Преимущества | Недостатки |
|---|---|
| Высокая эффективность процесса с точки зрения равномерности и качества покрытия. | Высокие требования к качеству подготовки поверхности детали перед процессом осаждения. |
| Возможность получения покрытия с заданными характеристиками. | Сложность контроля и регулирования процесса. |
| Широкий спектр применения в различных отраслях промышленности. | Необходимость в специальном оборудовании и условиях для проведения процесса. |
В целом, электролитическое осаждение является эффективным методом формирования покрытий на металле, который находит применение в различных отраслях промышленности. Однако требования к подготовке поверхности и сложность контроля процесса делают его реализацию относительно сложной.
Формирование межфазных границ

Межфазные границы возникают при контактировании двух разных металлов и представляют собой области на границе раздела между ними. Они обладают особыми физическими и химическими свойствами, поскольку содержат атомы обоих металлов и могут образовывать различные структуры.
При контакте металлов происходит диффузия атомов между ними, что приводит к образованию сплава и получению сложной структуры, включающей межфазные границы. На межфазных границах атомы металлов могут образовывать различные структуры, такие как идеальные решетки, дефектные решетки и интерфейсы.
Межфазные границы являются местом активности различных физических и химических процессов. Они влияют на свойства материала, такие как прочность и электропроводность. Межфазные границы также могут быть местом образования дислокаций и других дефектов, которые могут привести к повреждению материала.
Исследование межфазных границ имеет большое значение в различных областях науки и инженерии, таких как металлургия, электроника и материаловедение. Изучение структуры и свойств межфазных границ помогает лучше понять процессы, происходящие при контактировании металлов, и разработать новые материалы с улучшенными свойствами.
- Межфазные границы образуются при контактировании двух разных металлов.
- Они обладают особыми физическими и химическими свойствами.
- Межфазные границы характеризуются различными структурами.
- Они влияют на свойства материалов, такие как прочность и электропроводность.
- Изучение межфазных границ имеет большое значение в науке и инженерии.
Вопрос-ответ

Какие явления возникают при контактировании двух разных металлов?
При контактировании двух разных металлов могут возникать различные явления, включая электролиз, гальваническую коррозию и гальваническую пару. Эти явления связаны с различиями в электрохимических свойствах металлов и их склонности к окислению.
Почему при контактировании двух разных металлов может возникнуть электролиз?
При контактировании двух разных металлов образуются гальванические элементы, в которых происходит электрохимический процесс. В результате этого процесса один из металлов выступает в роли анода, а другой - в роли катода. Это приводит к протеканию электрического тока через электролит. Электролиз возникает из-за разности в электрохимических потенциалах металлов.
