Электролиз является важным процессом, который позволяет восстановить и очистить металлы от различных примесей. Он основан на использовании электрического тока, который проходит через электролитическую ячейку, содержащую раствор с ионами металла. При прохождении тока между электродами происходят химические реакции, в результате которых происходит восстановление металла.
Электролиз может быть использован для очистки и восстановления различных видов металлов, включая железо, медь, серебро и золото. Во время процесса электролиза ионы металла перемещаются к катоду, где они получают электроны и образуют металлические атомы. Тем временем, ионы примеси перемещаются к аноду, где они окисляются и образуют соединения, которые отделяются от восстанавливающегося металла.
Электролиз часто используется в промышленных процессах для восстановления и очистки металла. Например, в процессе гальванического покрытия металла на поверхность другого металла, электролиз позволяет нанести тонкий слой металла с заданными свойствами на поверхность изделия. Также электролиз может использоваться для извлечения металла из руды или отходов и его последующей очистки от примесей.
В заключение, процессы электролиза играют важную роль в восстановлении и очистке металлов. Они позволяют не только получить металл высокой чистоты, но и применять его в различных отраслях промышленности для создания качественной и надежной продукции.
Электролиз металлических оксидов

Электролиз металлических оксидов - это процесс, при котором с помощью электрического тока происходит восстановление металлов из их оксидов. Этот процесс является одним из основных методов получения металлов и используется в различных промышленных отраслях.
Основной принцип электролиза металлических оксидов основан на использовании электролитической ячейки, состоящей из анода и катода, погруженных в электролит. Анодом обычно служит металлический оксид, а катодом - непосредственно металл, который необходимо восстановить. При подаче электрического тока на анод и катод происходят реакции окисления и восстановления соответственно.
В результате электролиза металлических оксидов на аноде происходит окисление металлического оксида с образованием кислорода и электролитического раствора металла. Кислород выделяется в виде газа или растворяется в электролите. На катоде происходит восстановление металла из электролитического раствора с образованием металлического осадка.
Процесс электролиза металлических оксидов может быть использован для получения широкого спектра металлов. Например, таким процессом можно получать алюминий из его оксида - оксида алюминия. Также этот метод успешно применяется для получения таких металлов как магний, никель, цинк, медь и др. Электролиз металлических оксидов является эффективным инструментом в производстве металлов и находит широкое применение в различных отраслях промышленности.
Электролиз водных растворов солей металлов

Электролиз водных растворов солей металлов является одним из основных методов получения металлов из их соединений. Этот процесс основан на применении электрической энергии для разложения раствора соли на ионы.
Для проведения электролиза используются специальные устройства, называемые электролизерами. Электролиз выполняется в проводящих емкостях, в которых находятся аноды и катоды. Аноды служат для окисления анионов в растворе, тогда как катоды предназначены для восстановления катионов.
В процессе электролиза водных растворов солей металлов происходит разделение положительно и отрицательно заряженных ионов. Катионы переносятся к катоду, где происходит их восстановление и осаждение на поверхности в виде металла. Например, при электролизе раствора соли меди на катоде осаждаются атомы меди, которые накапливаются в виде осаждения.
Электролиз водных растворов солей металлов является важным процессом не только для получения металлов, но и для разделения и очистки растворов. Этот метод позволяет получать чистые металлы, обладающие высокой степенью чистоты и качества. Благодаря электролизу можно получать различные металлы, включая алюминий, никель, цинк и другие, и использовать их в различных отраслях промышленности и научных исследованиях.
Электролиз расплавов
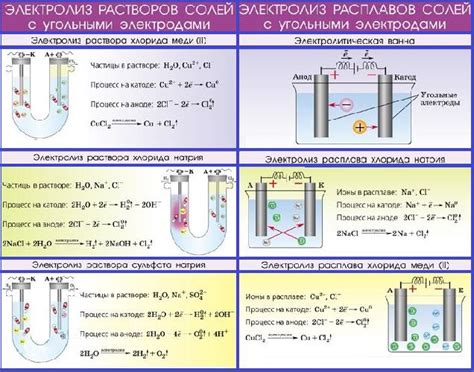
Электролиз расплавов - это процесс, который осуществляется с помощью электрического тока и позволяет восстанавливать металлы из их соединений в расплавленном состоянии. Этот метод широко применяется в металлургии для получения различных металлических продуктов.
Основной принцип электролиза расплавов заключается в том, что расплав, содержащий соединение металла, помещается в электролитическую ванну, где служит анодом, а катодом выступает электрод из металла, который должен быть восстановлен. При подаче электрического тока происходят реакции окисления и восстановления, что позволяет выделить металл на катоде.
Для электролиза расплавов обычно используются электроды из титана или других инертных материалов, чтобы избежать их растворения в электролите. Кроме того, катодный электрод часто обладает пористой структурой или покрытием, что способствует увеличению площади поверхности и эффективности процесса восстановления.
Преимущества электролиза расплавов:
- Позволяет получать металл высокой чистоты;
- Эффективен для восстановления металлов из очень тугоплавких соединений;
- Высокая пропускная способность процесса, что позволяет получать большие объемы продукции;
- Возможность использования низкотемпературных расплавов;
- Уменьшение выбросов и загрязнений окружающей среды.
Некоторые примеры электролиза расплавов в индустрии включают получение алюминия из бокситового рудника, восстановление магния из его солей и получение цветных металлов, таких как медь и никель.
Электролиз растворов кислот
Электролиз растворов кислот – это процесс, при котором в результате электрического разложения кислотного раствора происходит восстановление металла. Этот процесс основан на принципе электрохимии и широко используется в промышленности для получения металлов.
Кислоты, как правило, содержат ионный вид в водном растворе. Во время электролиза, две половины реакции происходят на электродах. На положительном электроде (аноде) происходит окисление анионов кислоты, а на отрицательном электроде (катоде) происходит восстановление металла.
Процесс электролиза растворов кислот может производиться в различных условиях, таких как температура, сила тока и концентрация кислоты. Важно подобрать оптимальные параметры, чтобы обеспечить эффективность процесса и получить высококачественный металл.
Для проведения электролиза растворов кислот используют специальные электролитические ячейки. В этих ячейках кислотный раствор подается через специальные камеры, где происходит разложение под воздействием электрического тока. Результатом электролиза является образование металла на катоде и испарение кислотных ионов на аноде.
Электролиз растворов кислот является важным процессом при получении различных металлов, таких как цинк, медь, свинец и т.д. Этот метод позволяет получить металлы высокой чистоты и широко используется в металлургии, электротехнике и других отраслях промышленности.
Вопрос-ответ

Что такое электролиз?
Электролиз - это процесс, в ходе которого приложенная электрическая энергия используется для преобразования соединений, включая растворы солей и расплавы металлов.
Как происходит процесс электролиза?
Процесс электролиза осуществляется путем пропускания электрического тока через электролит - вещество, способное проводить электрический ток. При этом происходит разложение вещества на положительно заряженные и отрицательно заряженные ионы, которые движутся к полюсам электролита и взаимодействуют с электродами.
