Реакция солей с металлами является одним из важных химических процессов, которые возникают при взаимодействии различных веществ. Этот процесс происходит при соединении ионов металлов с ионами солей. Условия и особенности взаимодействия зависят от свойств металлов и солей, а также от степени их реакционной активности.
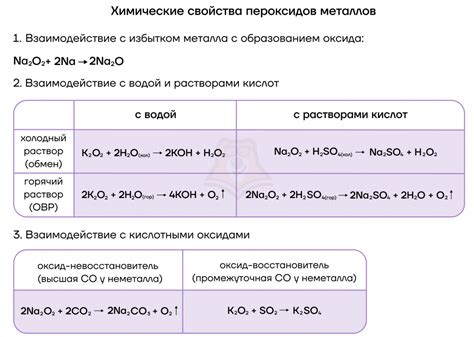
Одной из основных особенностей реакции солей с металлами является образование осадков или отделяемых газов. При этом ионы металлов вступают в реакцию с ионами соли, образуя более стабильные соединения. Реакция может протекать как в растворе, так и на границе фазы металл-раствор. В некоторых случаях реакция может происходить только при наличии определенных условий, например, при нагревании реагентов или использовании катализаторов.
Условия взаимодействия солей с металлами также зависят от реакционного потенциала металла. Металлы могут обладать различной активностью и способностью к вступлению в реакцию с солью. Некоторые металлы, такие как натрий или калий, являются очень активными и способны образовывать стабильные соединения с широким спектром солей. В то же время, более инертные металлы, такие как золото или платина, имеют ограниченные возможности для реакции с солями.
Кроме того, взаимодействие солей с металлами может иметь как положительные, так и отрицательные последствия. Некоторые реакции могут приводить к образованию полезных веществ, которые широко используются в различных отраслях промышленности. Однако, неконтролируемые реакции могут привести к образованию токсичных соединений или вызвать коррозию металлов. Поэтому, при проведении таких реакций необходимо соблюдать определенные условия и контролировать процесс взаимодействия.
Условия взаимодействия солей с металлами

Реакции солей с металлами происходят при определенных условиях, которые могут зависеть от различных факторов, таких как тип реакции, реагенты, растворитель и окружающая среда.
Тип реакции: Взаимодействие солей с металлами может проходить по разным типам реакций, таким как окисление-восстановление, замещение, образование комплексных соединений.
Реагенты: Важную роль в реакции играют и сами реагенты - соли и металлы. Химические свойства и степень активности металлов, а также их концентрация в реакции могут влиять на скорость и характер взаимодействия.
Растворитель: В основном реакции солей с металлами происходят в водных растворах. Растворитель играет важную роль, так как может влиять на скорость реакции, растворимость солей и возможность образования комплексных соединений.
Окружающая среда: Физические и химические условия в окружающей среде также могут повлиять на ход реакции. Температура, давление, наличие катализаторов или ингибиторов могут ускорить или замедлить реакцию.
Также важным фактором является степень активности металла, так как металлы могут иметь различные химические свойства и скорость реакции может зависеть от их способности к окислению и диссоциации.
Температурный режим взаимодействия

Реакция солей с металлами обычно протекает при повышенной температуре. Это связано с тем, что при высоких температурах ионная активность реагентов увеличивается, что способствует их взаимодействию. Однако не все соли и металлы имеют одинаковую температурную зависимость реакции.
Некоторые соли могут реагировать с металлами уже при комнатной температуре, например, нитраты и хлориды щелочных металлов. Такие реакции обычно протекают достаточно быстро и сопровождаются образованием газов или осадка.
Для некоторых солей и металлов требуется нагревание до высоких температур, например, карбонаты и оксиды серебра, меди, железа и других металлов. При этом происходит термическое разложение соли, и металл образует соединение с кислородом из соли. Такие реакции часто сопровождаются выделением газов и изменением цвета реакционной смеси.
В некоторых случаях реакция солей с металлами может протекать при пониженных температурах. Например, при взаимодействии хлорида железа(II) с алюминием, реакция протекает при температуре около 150-200°С. При этом образуются газы и образуется соединение между алюминием и железом.
Окружающая среда и реакции солей с металлами
Окружающая среда имеет огромное влияние на реакции солей с металлами. Взаимодействие между солями и металлами может происходить как в водной среде, так и в других средах, таких как воздух или газы.
В водной среде реакции солей с металлами особенно интенсивны, так как вода является хорошим растворителем для многих солей и обладает высокой подвижностью молекул. Это позволяет ионам солей и металлам взаимодействовать между собой с большой скоростью и эффективностью.
Однако реакции солей с металлами в водной среде могут также зависеть от температуры и рН среды. Например, некоторые металлы могут реагировать с водой только при высоких температурах или в кислой среде. Это связано с их химическими свойствами и способностью образовывать стойкие соединения с водой.
В реакциях солей с металлами в других средах, таких как воздух или газы, также играют роль окружающие условия. Например, наличие кислорода и влаги в воздухе может ускорить окисление металлов, а наличие других газов может вызывать обратные реакции или образование новых соединений.
Выводящая вещество и его концентрация также оказывают влияние на реакции солей с металлами. Некоторые вещества могут способствовать растворению ионов солей или, наоборот, замедлять этот процесс. Кроме того, концентрация ионов и растворенных газов может влиять на скорость реакции и образование новых соединений.
Концентрация солей и взаимодействие с металлами
Взаимодействие солей с металлами зависит от их концентрации. Вещества с высокой концентрацией солей могут привести к интенсивной реакции с металлами, включая образование газов и выделение энергии в виде тепла или света.
Низкая концентрация солей, напротив, может замедлить реакцию между солью и металлом или не вызывать ее вовсе. Это связано с тем, что количество ионов в растворе невелико и их взаимодействие с поверхностью металла ограничено.
Концентрация солей также влияет на скорость реакции между солью и металлом. При реакции с высокой концентрацией солей, поверхность металла может быть равномерно покрыта ионами соли, что способствует быстрой реакции.
Иногда некоторые ионы солей могут вызывать наличие пассивной пленки на поверхности металла, которая затем предотвращает дальнейшее взаимодействие с реагентами. В таких случаях концентрация солей может быть регулирована для получения желаемого реакционного процесса.
Особенности взаимодействия солей с металлами

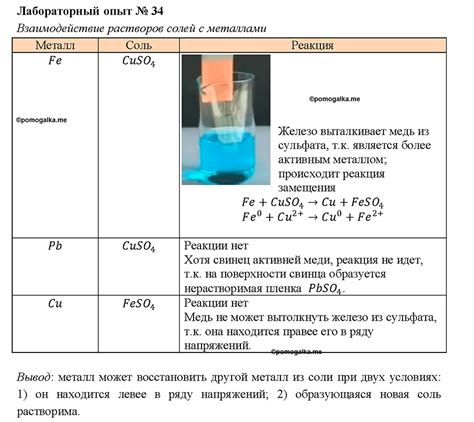
Взаимодействие солей с металлами является одним из ключевых процессов в химии. Когда соль вступает в реакцию с металлом, происходит обмен ионами: ионы металла соли замещают ионы металла в реагенте.
При взаимодействии солей с металлами могут возникать различные реакции, в зависимости от свойств соли и металла, а также условий реакции. Например, при реакции металла со соляной кислотой, образуется хлорид металла и водород. Если соль обладает окислительными свойствами, реакция может происходить с выделением тепла и образованием оксида металла.
Одной из особенностей взаимодействия солей с металлами является их способность к диссоциации в растворе. Соли, состоящие из катионов и анионов, могут разлагаться на отдельные ионы при взаимодействии с раствором. Это позволяет металлам и их ионам свободно взаимодействовать с ионами солей и выполнять различные химические реакции.
Важным аспектом взаимодействия солей с металлами является их селективность. Различные металлы могут проявлять разную реакционную способность и взаимодействовать с солями по-разному. Некоторые металлы могут образовывать осадки с определенными солями, что может быть использовано в аналитической химии для определения наличия определенного металла в растворе.
Таким образом, особенности взаимодействия солей с металлами определяются свойствами соли и металла, а также условиями реакции. Это важный аспект химии, который находит применение в различных областях науки и промышленности.
Образование осадка при реакции солей с металлами

Реакция солей с металлами может привести к образованию осадка, который выпадает из раствора. Это явление является результатом химической реакции между ионами металла и анионами соли. Образуются различные типы осадков, в зависимости от конкретных условий и особенностей взаимодействия.
Осадок можно получить при реакции солей с металлами в виде твердого вещества, обладающего определенными свойствами. Такие осадки обычно образуются при общем двойном разложении растворов солей металлов, когда анионы и катионы обмениваются местами. Для этого реакции требуется соответствующее сочетание реагентов, включая выбор определенной пары солей.
Факторы, влияющие на образование осадка, включают концентрацию реагентов, температуру, рН раствора и наличие других добавок. Например, изменение концентрации солей металлов или солей кислоты может изменить скорость и степень образования осадка. Также важен характер солей, их растворимость и способность давать осадки при реакции с металлами.
Образование осадка является одним из методов анализа и исследования химических реакций. Оно может быть использовано для определения наличия и количества определенного металла в растворе, а также для изучения его химических свойств. Точность и результативность этого метода зависит от тщательного контроля условий реакции и правильного подбора реагентов.
Изменение цвета раствора при взаимодействии солей с металлами

При взаимодействии солей с металлами происходит образование новых соединений, которые могут иметь различные цвета. Изменение цвета раствора является одним из основных признаков химической реакции между солями и металлами.
Цвет раствора зависит от многих факторов, включая напряжение, наличие кислорода, концентрацию солей и металлов, а также некоторые другие условия реакции. Например, при взаимодействии солей железа с металлом меди образуется раствор синего цвета, в то время как соединение железа с цинком даёт жёлтый раствор.
Один и тот же металл может образовывать разные соединения с солью, в зависимости от условий реакции. Например, соединение меди с хлоридом натрия даёт зеленый раствор, а соединение с нитратом натрия – голубой. Это объясняется разными степенями окисления меди в различных соединениях.
Изменение цвета раствора при взаимодействии солей с металлами имеет большое практическое значение и широко применяется в химическом анализе. Этот признак используется для определения различных металлов в смесях солей, а также для контроля качества промышленных растворов и процессов.
Реакция солей с металлами разных химических свойств

Соли являются химическими соединениями, образованными в результате реакции кислоты и основания. Они играют важную роль в различных процессах, в том числе взаимодействии с металлами. Такая реакция может проходить с металлами разных химических свойств, и в зависимости от них проявляются различные особенности и условия взаимодействия.
Соль металла может реагировать с металлом активнее себя, если металл активнее не имеет стабильные свойства. При этом может происходить образование раствора соли и вывод нестабильного металла в виде иона в раствор.
Соли металлов могут реагировать с щелочными и амфотерными металлами с образованием осажденных гидроксидов металлов. Например, сульфат меди (II) реагирует с натрием, образуя осадок гидроксида меди (II). Такие реакции протекают в базической среде.
Кроме того, есть реакции с металлами, с которыми соли могут не реагировать. Например, соль железа не реагирует с недостаточно активными металлами, такими как золото или платина. В таких случаях образуется просто смесь металлов и соли.
Таким образом, реакция солей с металлами разных химических свойств имеет свои особенности и зависит от активности металла и химической природы солей. Она может протекать с образованием растворов солей, осадков гидроксидов, или не происходить вовсе при отсутствии реакционной способности металла.
Вопрос-ответ

Какие металлы могут реагировать с солями?
Реакция металлов с солями происходит только с определенными металлами. Например, активные металлы, такие как натрий, калий и магний, могут реагировать с солями. Другие металлы, такие как железо и алюминий, также могут реагировать, но обычно требуется наличие кислоты или другого катализатора.
Какова реакция солей с металлами?
Реакция солей с металлами может происходить различными способами. В некоторых случаях металл может замещать другой металл в соли, образуя новую соль и выделяя металл в свободной форме. В других случаях металл может просто раствориться в соли, образуя новые соединения.
