Электролиз водных растворов солей является важным процессом, который можно наблюдать в химической лаборатории и применять в промышленности. Один из интересных аспектов этого процесса - выделение металла только на катоде, при этом анион соединения не участвует в реакции. В данной статье мы рассмотрим причины такого поведения и проанализируем основные физико-химические процессы, которые происходят во время электролиза.
Основу электролиза водных растворов солей составляет принцип разложения вещества под действием электрического тока. Рассмотрим пример: при электролизе раствора медного (CuSO4) или серебрянного (AgNO3) соединений, на катоде выделяется только металл (Cu или Ag), а на аноде происходит окисление воды кислородом. Это связано с разницей в электрохимической активности между металлом и анионом.
На катоде происходит процесс редукции металла, который имеет более низкую электрохимическую активность (Eметалла) по сравнению с H2 (самым активным анионом в растворе). Таким образом, металл снижает свою окислительную способность, принимая электроны с катода и оседая на его поверхности в виде металлического осадка. При этом активный анион не участвует в реакции, так как его окислительная способность выше, чем у металла.
Таким образом, электролиз водных растворов солей позволяет осуществлять получение металлических осадков на катоде. Этот процесс имеет широкое применение в различных отраслях, включая электрохимическое производство и химический анализ. Понимание механизма электролиза водных растворов солей позволяет предсказывать результаты реакции и контролировать ход процесса с высокой точностью.
Процесс электролиза водных растворов солей
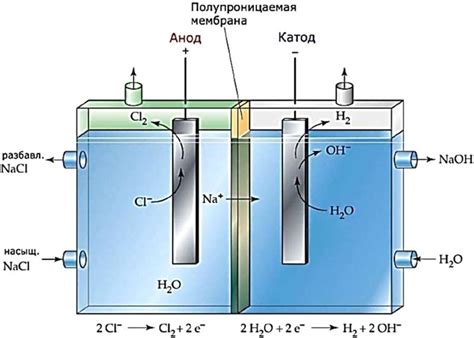
Электролиз водных растворов солей является важным химическим процессом, применяемым в различных областях, таких как производство металлов, электрохимические технологии и аналитическая химия.
Во время электролиза происходит разложение соли на ионы, которые перемещаются к электродам под воздействием электрического тока. В результате этого процесса на катоде образуется металл, в то время как на аноде происходит окисление ионы воды или гидроксидные ионы.
На катоде выделяется только металл по причине его более высокого стандартного потенциала восстановления по сравнению с водой или гидроксидными ионами. Это означает, что металл имеет большую тенденцию восстановиться из ионного состояния обратно в металлическое состояние при наличии электрического поля.
С другой стороны, ионы воды или гидроксидные ионы имеют более низкий стандартный потенциал окисления, что делает их менее склонными к окислению на катоде. В результате, при электролизе водных растворов солей, на катоде образуется только металл, тогда как вода или гидроксидные ионы не подвергаются окислению.
Электролиз водных растворов солей является важным инструментом исследования и промышленности, позволяя получать металлы с высокой чистотой и контролировать процессы окисления и восстановления. Он также играет роль в производстве электролитических растворов и электрокатализаторов.
Причины выделения металла на катоде

1. Электрохимический потенциал
При электролизе водных растворов солей на катоде происходит восстановление металла. Это связано с тем, что электрохимический потенциал металла ниже потенциала водорода. В результате, когда водород и металл конкурируют за электроны, металл имеет преимущество и выделяется на катоде.
2. Разность электрических потенциалов
Между анодом и катодом, при электролизе водных растворов солей, образуется разность электрических потенциалов. Эта разность вызывает направленное движение ионов в растворе. Катионы металла, находящиеся в растворе, притягиваются к катоду и восстанавливаются в металлическую форму.
3. Сила тока
Сила тока, протекающего через электролит при электролизе, также влияет на выделение металла на катоде. Чем выше сила тока, тем больше металла осаждается на катоде за единицу времени. Это обуславливается более интенсивным движением ионов металла к катоду.
4. Потенциал раствора
Потенциал раствора, то есть химический потенциал соли, также оказывает влияние на выделение металла на катоде. Если потенциал раствора ниже потенциала водорода, происходит восстановление металла на катоде. В случае, когда потенциал раствора выше потенциала водорода, происходит выделение водорода.
5. Реакции конкурирующих ионов
В растворе могут присутствовать не только ионы металла, но и другие ионы, которые также могут быть восстановлены. Однако, благодаря особенностям потенциала и реакционной способности ионов, именно металл имеет большую склонность к восстановлению, что приводит к его осаждению на катоде.
Вопрос-ответ

Как происходит электролиз водных растворов солей?
При электролизе водных растворов солей происходит разложение веществ на ионы в результате воздействия электрического тока. При этом положительно заряженные ионы (катионы) перемещаются к аноду, а отрицательно заряженные ионы (анионы) перемещаются к катоду.
Почему на катоде при электролизе водных растворов солей выделяется только металл?
На катоде при электролизе водных растворов солей выделяется только металл, потому что он имеет наименьшую степень окисления из всех ионов, присутствующих в растворе. Катод - это отрицательно заряженный электрод, к которому притягиваются положительно заряженные ионы. Таким образом, металл, который имеет наибольшую аффинность к электроду, будет первым выброшен на катоде.
Можно ли получить газ на катоде при электролизе водных растворов солей?
Да, на катоде при электролизе водных растворов солей можно получить газ. Это происходит, когда в растворе присутствуют ионы, способные вступать в реакции с водой, образуя газы. Например, при электролизе раствора хлорида натрия на катоде будет выделяться водородный газ, так как вода может быть редуцирована ионами гидрона, образуя водород.
Что происходит с анионами во время электролиза водных растворов солей?
Во время электролиза водных растворов солей, анионы перемещаются к катоду, где происходят различные процессы. Например, анионы могут вступать в реакции с водой или с электродом. В результате этих реакций могут выделяться газы или образовываться соединения с электродом. В целом, происходит перераспределение зарядов между анионами и катионами в растворе.
