В рамках изучения химии в 9 классе ученикам предлагается провести презентацию по габриеляну о соединении щелочноземельных металлов. Эта тема позволяет углубить знания об элементах второй группы периодической таблицы и их соединениях.
В ходе презентации ученики смогут узнать о физических и химических свойствах щелочноземельных металлов, таких как магний, кальций, стронций, барий и радий. Особое внимание будет уделено соединениям этих металлов с разными элементами, такими как кислород, сера, фосфор и другие.
Важным аспектом презентации будет изучение реакций щелочноземельных металлов с различными веществами и их применение в жизни, например, в производстве лекарств, сплавов и т.д. Ученики смогут ознакомиться с реакционными схемами и узнать о технологиях получения этих соединений.
Изучение щелочноземельных металлов и их соединений в 9 классе является важным этапом в познании мира химии. Учебная презентация по габриеляну вносит важный вклад в расширение знаний учеников и формирует интерес к науке.
Габриелян: презентация о соединении щелочноземельных металлов в 9 классе

Габриелян — русский ученый, известный своими исследованиями в области химии. Одной из его активно изучаемых тем является соединение щелочноземельных металлов. Это группа химических элементов, которая включает бериллий, магний, кальций, стронций, барий и радий.
Габриелян открыл, что щелочноземельные металлы обладают высокой реактивностью и активно образуют соединения со многими другими элементами. Он изучал особенности образования и свойства этих соединений, а также их влияние на различные процессы и явления.
По результатам исследований Габриеляна было установлено, что соединения щелочноземельных металлов обладают рядом особенностей. Они обладают высокой термической и электрической проводимостью, а также обладают специфическими магнитными и оптическими свойствами.
Изучение соединения щелочноземельных металлов имеет огромное практическое значение. К примеру, они широко применяются в производстве сплавов, керамики, аккумуляторных батарей и многих других технологических процессах. Понимание свойств и способов получения этих соединений позволяет разрабатывать новые материалы и технологии с улучшенными свойствами и характеристиками.
Основы соединения щелочноземельных металлов

Щелочноземельные металлы - это группа химических элементов, которые находятся во второй группе периодической таблицы. В эту группу входят металлы, такие как бериллий, магний, кальций, стронций, барий и радий. Эти металлы являются очень реактивными и образуют различные соединения с другими элементами.
Одним из важных аспектов соединения щелочноземельных металлов является их склонность к образованию ионов с положительным зарядом. Эти ионы имеют два валентных состояния, что позволяет им образовывать различные типы химических соединений.
Соединения щелочноземельных металлов могут быть использованы в широком спектре промышленных и научных приложений. Бериллий, например, используется в производстве сплавов и керамики, а магний - в производстве легких сплавов и магниевых солей.
Одним из наиболее распространенных типов соединений щелочноземельных металлов являются оксиды и гидроксиды. Оксиды представляют собой соединения, в которых щелочноземельный металл соединяется с кислородом, а гидроксиды - соединения, в которых металл соединяется с гидроксильной группой.
- Оксиды щелочноземельных металлов обычно хорошо растворимы в воде и обладают щелочными свойствами. Они могут использоваться как сильные основания в различных химических реакциях.
- Гидроксиды щелочноземельных металлов также обладают щелочными свойствами и часто используются в производстве щелочей, мыла и других химических продуктов.
Соединения щелочноземельных металлов имеют важное значение в химической промышленности и научных исследованиях. Изучение основ соединения этих металлов помогает нам лучше понять их свойства и использовать их в различных областях науки и технологии.
Правила соединения щелочноземельных металлов
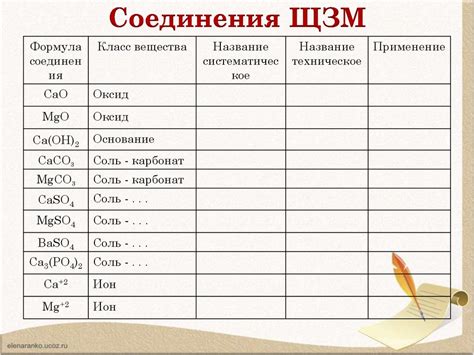
Для соединения щелочноземельных металлов с другими элементами действуют определенные правила. Учитывая их, можно получить различные структуры и свойства соединений.
1. Соединение с кислородом:
- Щелочноземельные металлы образуют оксиды, имеющие общую формулу MO, где M - металл щелочноземельного ряда. Каждый металл образует свой непростой оксид.
- Оксиды щелочноземельных металлов обладают соотношением электроотрицательности элементов, которое позволяет им образовывать ионную связь.
- Простые оксиды щелочноземельных металлов являются основаниями и образуют гидроксиды.
2. Соединение с халогенами:
- Щелочноземельные металлы образуют с халогенами соединения, имеющие общую формулу MX2, где M - металл щелочноземельного ряда, X - халоген.
- Соединения обладают ионной связью.
- Хлориды щелочноземельных металлов имеют высокую плавление и кипение и образуют бесцветные кристаллы.
3. Соединение с серой:
- Щелочноземельные металлы образуют с серой соединения, имеющие общую формулу MS, где M - металл щелочноземельного ряда.
- Соединения образуются из-за разности электроотрицательности элементов и они обладают ионной связью.
- Сернистые соединения щелочноземельных металлов имеют характерный запах и являются твердыми веществами.
4. Соединение со спиртами:
- Щелочноземельные металлы могут соединяться с органическими спиртами и давать соответствующие алкоголи.
- Соединения образуются в результате замещения водорода в молекуле спирта металлом щелочноземельного ряда.
- Некоторые алкоголи щелочноземельных металлов обладают хорошей растворимостью в воде.
В результате соединения щелочноземельных металлов с различными элементами, образуются соединения с разными свойствами и структурами, которые имеют широкое применение в различных областях науки и техники.
Химические свойства соединений щелочноземельных металлов

Соединения щелочноземельных металлов обладают рядом химических свойств, которые определяют их поведение и важность в различных процессах и реакциях.
1. Реакция с водой: Вода активно взаимодействует с щелочноземельными металлами, образуя гидроксиды. Реакция происходит с выделением водорода и образованием осадка гидроксида металла.
2. Реакция с кислотами: Щелочноземельные металлы реагируют с кислотами, выделяя водород и образуя соли. Реакция с кислотами происходит с большим выделением тепла.
3. Реакция с кислородом: Щелочноземельные металлы активно соединяются с кислородом из воздуха, образуя оксиды. Реакция происходит с выделением большого количества тепла.
4. Реакция с неметаллами: Щелочноземельные металлы реагируют с неметаллами, образуя соединения, которые могут быть как ионными, так и ковалентными.
5. Способность к образованию растворов: Гидроксиды щелочноземельных металлов хорошо растворяются в воде, образуя щелочные растворы, которые обладают высокой щелочностью.
6. Амфотерность: Некоторые соединения щелочноземельных металлов проявляют амфотерные свойства, то есть они могут реагировать как с кислотами, так и с щелочами.
В заключение можно сказать, что химические свойства соединений щелочноземельных металлов определяют их широкое применение в различных отраслях науки и техники, а также их важность в химических реакциях и процессах, происходящих в природе и в жизнедеятельности организмов.
Практическое применение соединений щелочноземельных металлов

Соединения щелочноземельных металлов (например, бериллий, магний, кальций) находят широкое применение в различных областях нашей жизни.
Одним из важных применений таких соединений является использование бериллия в производстве ядерных реакторов. Бериллий обладает высокой поглощающей способностью для нейтронов и хорошей теплопроводностью, поэтому он широко применяется в конструкциях реакторов. Благодаря своим уникальным свойствам, соединения бериллия помогают обеспечить безопасную и эффективную работу ядерных установок.
Магний и его соединения используются в авиационной и автомобильной промышленности. Магниевые сплавы обладают низкой плотностью, высокой прочностью и хорошей коррозионной стойкостью, из-за чего они широко применяются в производстве каркасов и деталей самолетов, автомобилей и велосипедов. Кроме того, магний может использоваться в производстве легких огнетушителей.
Кальций и его соединения играют важную роль в сельском хозяйстве. Кальций содержится во многих удобрениях, которые повышают плодородие почвы. Кальцийные удобрения помогают растениям эффективно поглощать влагу и питательные вещества, улучшают качество почвы и урожайность. Также кальциевые соединения находят применение в производстве стекла, цемента и керамики.
В заключение, соединения щелочноземельных металлов имеют широкий спектр практического применения в различных отраслях нашей жизни: от ядерной энергетики до сельского хозяйства. Они обладают уникальными свойствами, которые позволяют сделать нашу жизнь безопаснее, эффективнее и комфоpтнее.
Вопрос-ответ

Какие щелочноземельные металлы могут соединяться?
Щелочноземельные металлы, такие как магний, кальций, стронций, барий и радий, могут соединяться с различными элементами, образуя разнообразные соединения.
Какие электроны отдают щелочноземельные металлы?
Щелочноземельные металлы отдают два электрона из своей внешней энергетической оболочки при образовании соединений.
В каких соединениях чаще всего встречаются щелочноземельные металлы?
Наиболее распространены соединения щелочноземельных металлов с кислородом (оксиды) и c халкогенами (серой, селеном, теллуром).
Какие свойства имеют соединения щелочноземельных металлов?
Соединения щелочноземельных металлов обычно обладают высокой теплопроводностью, высокими температурами плавления и кипения, хорошей растворимостью в воде и образованием щелочей.
Какие примеры соединений щелочноземельных металлов можно привести?
Примеры соединений щелочноземельных металлов: оксиды (например, магниевый оксид MgO), гидроксиды (например, гидроксид кальция Ca(OH)2), карбиды (например, карбид стронция SrC2) и многое другое.
