Атом является базовой структурной единицей вещества и имеет своеобразное внутреннее строение. Особый интерес представляет атом металла, который обладает рядом уникальных свойств и играет важную роль в химических реакциях и синтезе различных соединений.
Строение атома металла определяется наличием ядра и электронной оболочки. Ядро атома металла состоит из протонов, обладающих положительным зарядом, и нейтронов, не имеющих заряда. Общая зарядовая плотность ядра создает потенциальный барьер для электронов, что делает атом металла стабильным и устойчивым.
Вокруг ядра находится электронная оболочка, состоящая из электронов, обладающих отрицательным зарядом. Количество электронов на каждой оболочке определяется его энергией, а также принципом заполнения энергетических уровней. Электроны находятся на определенных орбиталях, образуя электронные облака, которые определяют химические свойства атома металла.
Структура атома металла обусловливает его особенности, такие как электропроводность, пластичность и теплопроводность. Атомы металла могут образовывать ионные соединения с другими элементами, а также обладать металлической связью, которая обеспечивает их высокую плотность и прочность.
Строение атома металла
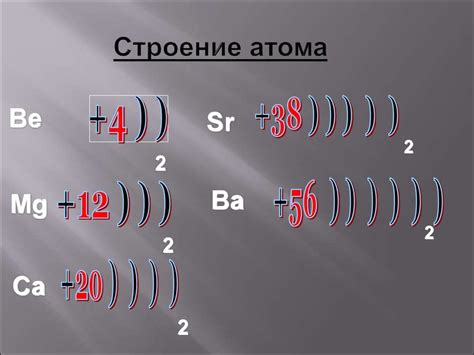
Атом металла является основным структурным элементом металлического вещества. Он состоит из электронов, протонов и нейтронов, которые находятся внутри ядра атома и в его электронных оболочках.
Ядро атома металла содержит протоны и нейтроны. Протоны имеют положительный заряд, а нейтроны не имеют заряда. Они существуют в ядре в виде плотного и компактного облака.
Электроны находятся в электронных оболочках вокруг ядра атома. Они имеют отрицательный заряд и движутся вокруг ядра по определенным энергетическим орбитам. Количество электронов в атому металла равно количеству протонов в ядре атома, что делает его электрически нейтральным.
Строение атома металла имеет свои особенности. Например, электроны распределены в оболочках по энергетическому уровню, начиная от наиболее близкой к ядру оболочки до наиболее удаленной. Важно отметить, что оболочки могут быть заполнены не полностью, что делает атом металла реактивным и способным участвовать в химических реакциях.
Сформировавшееся строение атома металла влияет на его свойства и химическую активность. Например, наличие свободных электронов во внешней оболочке делает металл проводником электричества. Кроме того, взаимодействие атомов металла обеспечивает их способность образовывать кристаллическую решетку.
Определение и значение атома металла

Атом металла - минимальная единица металлического элемента, состоящая из ядра и облака электронов. Ядро атома металла содержит положительно заряженные протоны и нейтроны, а облако электронов находится вокруг ядра и обладает отрицательным зарядом.
Атомы металлов имеют особые свойства, которые делают их уникальными и ценными. Во-первых, у атомов металлов довольно низкая электроотрицательность, что значит, что они легко отдают электроны. Это делает металлы отличными проводниками электричества и тепла.
Во-вторых, атомы металлов могут образовывать между собой ионные связи. Это происходит при переходе электронов от атома металла на атомы неметаллов. В результате такой связи образуется кристаллическая решетка, которая обладает металлическими свойствами, такими как пластичность и проводимость.
В-третьих, атомы металлов могут образовывать сплавы, смешиваясь с другими металлами или неметаллами. Это позволяет создавать новые материалы с улучшенными свойствами, такими как прочность, твердость или устойчивость к коррозии.
Таким образом, атомы металла играют важную роль в химии и технологии, обусловливая уникальные свойства металлических материалов и их широкое применение в различных областях промышленности.
Электронная оболочка атома металла
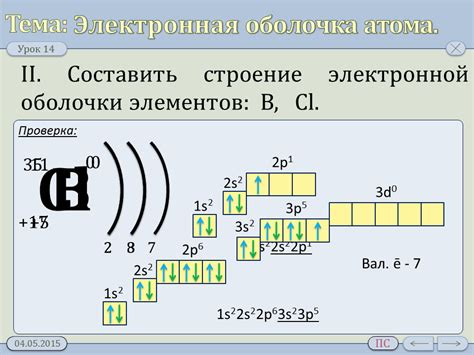
Электронная оболочка атома металла состоит из энергетических уровней, на которых находятся электроны. Эти уровни различаются по энергии и заполняются по особому принципу, известному как принцип заполнения электронных оболочек.
На первом энергетическом уровне, ближайшем к ядру, располагается 2 электрона. На втором уровне может находиться до 8 электронов, а на третьем - до 18 электронов. Количество электронов на каждом уровне определяется порядковым номером атома металла.
Электроны, находящиеся на самом близком к ядру уровне, называют валентными. Они обладают наибольшей энергией и играют основную роль в химических реакциях. Валентные электроны металлов легко участвуют в обмене с другими атомами, образуя связи и создавая соединения.
Электронная оболочка металла может быть разделена на подуровни, которые также имеют свои названия. Каждый подуровень может вместить определенное количество электронов. Например, s-подуровень может содержать до 2 электронов, p-подуровень - до 6 электронов, d-подуровень - до 10 электронов и f-подуровень - до 14 электронов.
На основе понимания строения электронной оболочки атома металла можно объяснить его химические свойства, в том числе способность образовывать ионы, взаимодействовать с другими элементами и образовывать соединения.
Ядро атома металла: нейтроны и протоны
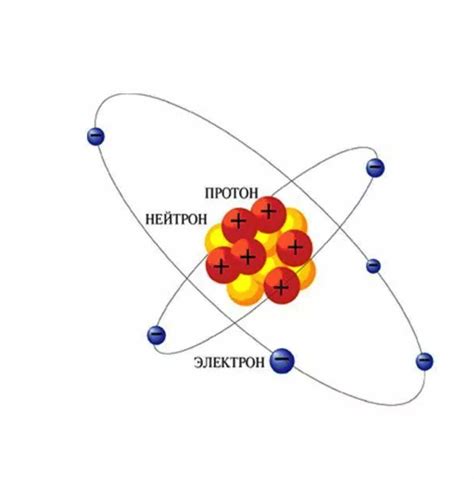
Ядро атома металла представляет собой центральную часть атома, которая содержит протоны и нейтроны. Протоны являются положительно заряженными частицами, в то время как нейтроны не имеют заряда и являются нейтральными.
Протоны и нейтроны существуют в ядре атома вместе и образуют его массу. Масса протонов и нейтронов примерно одинакова и считается равной 1 атомной единице массы (а.е.м.). Количество протонов в ядре определяет идентичность химического элемента, а массовое число является суммой протонов и нейтронов в ядре.
Протоны и нейтроны в ядре металлического атома находятся в постоянном движении. Их наличие обусловлено силами ядерного взаимодействия, которые притягивают протоны друг к другу и удерживают их вместе с нейтронами. Именно благодаря этим силам ядро атома металла остается нейтральным по заряду, несмотря на положительный заряд протонов.
Общее количество протонов в ядре атома металла называется атомным номером и определяет положительный заряд ядра. Например, у атома железа в ядре находится 26 протонов, соответственно, его атомный номер равен 26. Нейтроны же не оказывают прямого влияния на химические свойства атома, но влияют на его стабильность и являются одним из факторов, влияющих на его радиоактивность.
Элементарные частицы в атоме металла
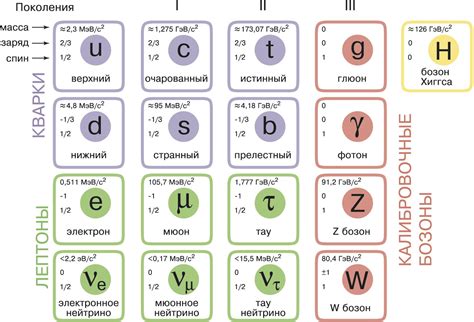
Атом металла состоит из нескольких типов элементарных частиц, которые взаимодействуют друг с другом и образуют его строение. Эти частицы включают электроны, протоны и нейтроны.
Электроны - отрицательно заряженные элементарные частицы, которые находятся вокруг ядра атома. Они движутся по энергетическим областям, называемым электронными оболочками. Количество электронов в атоме определяет его химические свойства.
Протоны - положительно заряженные элементарные частицы, которые находятся в ядре атома. Они имеют массу, примерно равную массе нейтрона. Количество протонов в ядре определяет атомный номер металла и его положение в таблице Менделеева.
Нейтроны - нейтрально заряженные элементарные частицы, которые также находятся в ядре атома. Они имеют массу, примерно равную массе протона. Нейтроны служат для поддержания стабильности ядра атома, уравновешивая отталкивающие силы между протонами.
В атоме металла электроны находятся в электронных оболочках, протоны и нейтроны сосредоточены в ядре. Эти элементарные частицы взаимодействуют друг с другом через электромагнитные силы, обеспечивая стабильность атома металла и его химические свойства.
Ионизация атома металла
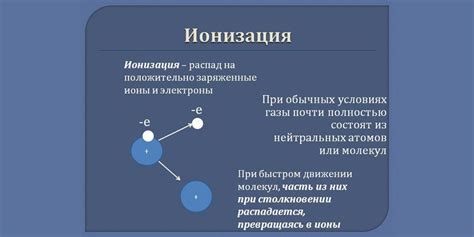
Ионизация атома металла — это процесс, в результате которого из атома металла образуются положительно заряженные ионы. Во время ионизации, один или несколько электронов, находящихся на внешних энергетических уровнях атома, отдаются, образуя положительные ионы.
Наиболее характерным примером ионизации металла является образование ионов натрия. В процессе ионизации натриевого атома, один электрон, находящийся на последнем энергетическом уровне, переходит на роль положительно заряженного иона Na+. Таким образом, ионизация приводит к потере электронов и изменению заряда атома металла.
Ионизация металла происходит под воздействием различных факторов, таких как температура, влияние других элементов, электромагнитное излучение и др. При повышении температуры атомы металла получают дополнительную энергию, что способствует их ионизации.
Ионизация металла играет важную роль в таких процессах, как проводимость электричества, образование растворов соляных кислотных остатков и других химических реакций. Ионы металлов имеют определенную зарядовую силу и могут быть использованы для создания электролитов и проводников электрического тока.
Способы исследования строения атома металла
Строение атома металла и его особенности можно изучать с помощью различных методов исследования. Одним из таких методов является рентгеноструктурный анализ.
Рентгеноструктурный анализ позволяет определить точное положение атомов в кристаллической решетке металла. С помощью рентгеновского излучения, проходящего через образец, получают дифракционную картину, которая содержит информацию о регулярности расположения атомов.
Другим способом исследования строения атома металла является электронная микроскопия. С помощью электронного микроскопа можно наблюдать металлическую поверхность с очень высоким разрешением, что позволяет увидеть отдельные атомы и их расположение.
Спектроскопические методы исследования также широко применяются при изучении строения атома металла. Например, рентгеновская флуоресценция позволяет определить тип и количество элементов, присутствующих в металлическом образце, а спектроскопия поглощения рентгеновского излучения позволяет определить энергетические уровни электронов в атоме металла и их возможные переходы.
Исследование строения атома металла является важным для понимания его свойств и возможности модификации. Комбинирование различных методов исследования позволяет получить более полную картину о строении атома металла и его взаимодействии с окружающей средой.
Вопрос-ответ

Что такое атом металла?
Атом металла - это минимальная частица металла, которая сохраняет химические свойства и состоит из ядра и электронной оболочки. Ядро атома содержит протоны и нейтроны, а электронная оболочка состоит из электронов, которые обращаются по разным орбитам.
Каково строение атома металла?
Строение атома металла состоит из ядра, которое содержит протоны и нейтроны, и электронной оболочки, состоящей из электронов. Ядро атома находится в центре и заряжено положительно. Электроны обращаются вокруг ядра по орбитам и заряжены отрицательно. Очень часто в атоме металла внешняя оболочка содержит свободные электроны, которые отвечают за его металлические свойства.
