Металлы являются одним из основных классов химических элементов и обладают рядом особенных химических свойств. Они обычно обладают металлическим блеском, хорошей электропроводностью и теплопроводностью. Кроме того, металлы способны образовывать ионы положительного заряда, которые обычно обладают высокими степенями окисления.
В процессе химических реакций металлы зачастую проявляют активность, образуя соединения с другими элементами. Они могут реагировать с кислородом, образуя оксиды, а также с водой, образуя гидроксиды. Многие металлы могут растворяться в кислотах, образуя соли и выделяя водород.
Одной из характерных особенностей металлов является их способность образовывать сплавы. Сплавы представляют собой смеси двух или более металлов, которые могут обладать улучшенными физическими или химическими свойствами по сравнению с отдельными металлами. Именно наиболее популярные сплавы, такие как сталь и бронза, широко используются в различных отраслях промышленности и строительства.
Металлы также отличаются высокой плотностью и твердостью, что делает их прочными и долговечными материалами. Благодаря этим свойствам они широко применяются в производстве различных изделий, начиная от автомобилей и самолетов, заканчивая бытовой техникой и электроникой. Важно отметить, что металлы также имеют способность быть подверженными коррозии, поэтому специальные методы защиты должны быть применены для сохранения их долговечности и эстетического вида.
В заключение, металлы являются важной частью нашей жизни и играют значительную роль в различных областях. Их уникальные физические и химические свойства делают их неотъемлемой частью промышленности, строительства и нашей повседневной жизни.
Общие свойства металлов: презентация по химии

Металлы - класс химических элементов, обладающих определенными свойствами, которые отличают их от неметаллов. У металлов есть несколько общих свойств:
- Проводимость электричества и тепла: Металлы обладают высокой электропроводностью, что позволяет им передавать электрический ток. Они также являются хорошими проводниками тепла, способствуя передаче тепла в различных процессах.
- Гибкость и формоизменяемость: Металлы обычно обладают высокой пластичностью и декоративностью, что позволяет им быть легко применяемыми в различных изделиях и конструкциях.
- Металлический блеск: Многие металлы имеют характерный блестящий внешний вид, который делает их привлекательными для использования в ювелирных изделиях и других декоративных предметах.
- Высокая плотность и твердость: Металлы обычно имеют высокую плотность и твердость, что делает их прочными и стойкими к различным внешним воздействиям.
- Способность к образованию сплавов: Металлы обладают способностью смешиваться с другими металлами и неметаллами, образуя сплавы с новыми свойствами и характеристиками.
Общие свойства металлов делают их важными и широко используемыми элементами в различных отраслях промышленности, электронике, строительстве и других областях.
Физические свойства металлов
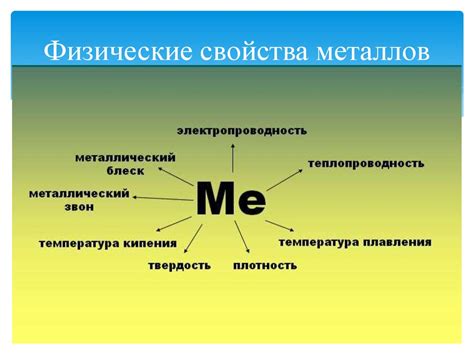
Проводимость: Металлы обладают высокой проводимостью электричества и тепла. Это связано с наличием свободных электронов, которые могут свободно передвигаться по металлической решетке.
Пластичность и прочность: Металлы обладают способностью легко формироваться и образовывать различные изделия. Они могут быть прокатаны, втиснуты, выгнуты, не теряя своих свойств. Это связано с наличием межмолекулярных связей, которые позволяют металлам сохранять свою структуру после деформации.
Магнитные свойства: Некоторые металлы обладают магнитными свойствами. Они могут притягиваться магнитом или самостоятельно обладать магнитной силой. Например, железо, никель и кобальт являются магнитными металлами.
Плотность: Металлы имеют высокую плотность – отношение массы металла к его объему. Благодаря этому они обладают большой массой, что делает их прочными и устойчивыми к воздействию внешних факторов.
Температура плавления и кипения: Металлы имеют высокие температуры плавления и кипения. Это обусловлено энергией связи между атомами в металлической решетке. Например, железо плавится при температуре около 1538°C, а кипит при температуре около 2861°C.
Цвет: Многие металлы обладают характерными цветами. Например, золото имеет желтый цвет, медь – красновато-коричневый цвет, а свинец – серо-белый цвет. Цвет металлов зависит от их электронной структуры и взаимодействия с видимым светом.
Технологические свойства металлов

Металлы являются важным материалом в различных отраслях промышленности и технологии благодаря своим уникальным технологическим свойствам.
Проводимость электричества и тепла: Металлы обладают отличной проводимостью электричества и тепла. Эта свойство делает их идеальным материалом для производства электрических проводов, различных электронных устройств и теплообменных элементов.
Подверженность окислению: Некоторые металлы, такие как железо и алюминий, подвержены окислению воздухом и влагой, образуя коррозию. Для защиты от коррозии часто применяются специальные покрытия или анодирование.
Пластичность и формовка: Металлы обладают высокой пластичностью, что позволяет легко изменять их форму методами горячей и холодной обработки. Это позволяет создавать разнообразные изделия с различными геометрическими формами.
Свариваемость: Металлы хорошо свариваются, что делает их удобными в процессе сборки и производства металлических конструкций. Сварка металлов позволяет соединять куски металла в одно целое и создавать прочные соединения.
Механические свойства: Металлы обладают высокой прочностью и твердостью, что позволяет им выдерживать большие нагрузки и служить основным строительным материалом в различных конструкциях.
Важно учитывать технологические свойства металлов при их использовании в производстве, чтобы гарантировать качество и долговечность конечных изделий.
Электрохимические свойства металлов
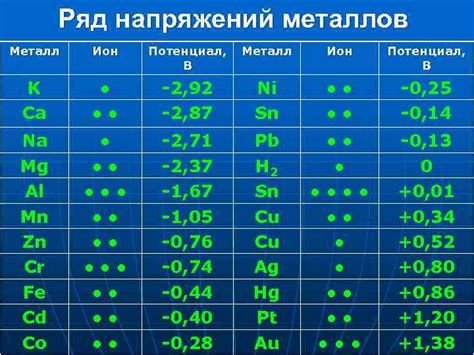
Электрохимические свойства металлов определяют способность металлов участвовать в различных электрохимических процессах, таких как окислительно-восстановительные реакции, коррозия и электролиз.
Одной из основных характеристик электрохимических свойств металлов является их электрохимический потенциал. Электрохимический потенциал металла определяет его способность вступать в окислительно-восстановительные реакции с другими веществамии определяется положением металла в ряду ЭМС (электрохимической серии).
Металлы с более высоким электрохимическим потенциалом (более отрицательным значением) являются более активными и могут выступать в качестве окислителя, тогда как металлы с более низкими электрохимическими потенциалами (более положительными значениями) обычно выступают в качестве восстановителя.
Также электрохимические свойства металлов проявляются в их способности образовывать ионные соединения или растворяться в водных растворах. Некоторые металлы образуют стабильные ионные соединения и имеют высокую растворимость, в то время как другие металлы могут быть стабильными только в нерастворимой форме.
Одним из важных аспектов электрохимических свойств металлов является их способность к коррозии. Металлы могут реагировать с окружающей средой, что приводит к образованию коррозионных отложений или снижению структурной прочности материала.
Химические свойства металлов в воздухе

Металлы - это элементы, которые обладают высокой электропроводностью, блеском, тугоплавкостью и способностью сращиваться друг с другом. Они образуют около 80% элементов таблицы химических элементов и встречаются в различных минералах.
Одним из важных свойств металлов является их способность реагировать с воздухом. Свободные металлы, такие как железо, алюминий и медь, могут окисляться при контакте с кислородом воздуха. Это процесс, известный как окисление металлов, и при этом на поверхности металла образуется пленка оксида.
Окисление металлов в воздухе обычно приводит к образованию тонкой пленки оксида, которая может предотвратить дальнейшую коррозию металла. В некоторых случаях окисление может продолжаться, особенно если поверхность металла повреждена или если воздух содержит вредные газы или влагу.
Некоторые металлы, такие как алюминий и нержавеющая сталь, образуют защитную пленку, которая предотвращает дальнейшее окисление. Однако другие металлы, такие как железо и медь, могут продолжать окисляться и в результате терять свои свойства и становиться менее прочными и долговечными.
Важно учитывать химические свойства металлов в воздухе при использовании и хранении металлических изделий. Коррозия может привести к ухудшению качества и эстетического вида изделий, поэтому необходимо предпринимать меры по защите металлов от окисления, например, с помощью специальных покрытий или смазок.
Химические свойства металлов в воде
Металлы обладают разнообразными химическими свойствами, включая их реакцию с водой. Взаимодействие металлов с водой может привести к образованию гидроксидов и выделению водорода.
Некоторые металлы, такие как натрий (Na) и калий (K), реагируют очень активно с водой, что приводит к выделению большого количества водорода и образованию гидроксидов металлов. Эти реакции проходят с выделением тепла и обычно сопровождаются искрообразованием.
Другие металлы, например, алюминий (Al) и цинк (Zn), реагируют с водой при нагревании, образуя гидроксиды. Эти реакции медленные и не столь активные, как реакции с натрием и калием.
Также существуют металлы, которые не взаимодействуют с водой при обычных условиях, например, серебро (Ag) и золото (Au). Эти металлы характеризуются высокой устойчивостью к окислению и коррозии.
Таким образом, химические свойства металлов в воде зависят от их активности и степени реакционной способности. Взаимодействие металлов с водой является важным аспектом изучения их химических свойств и имеет практическое значение в различных областях, включая промышленность и науку.
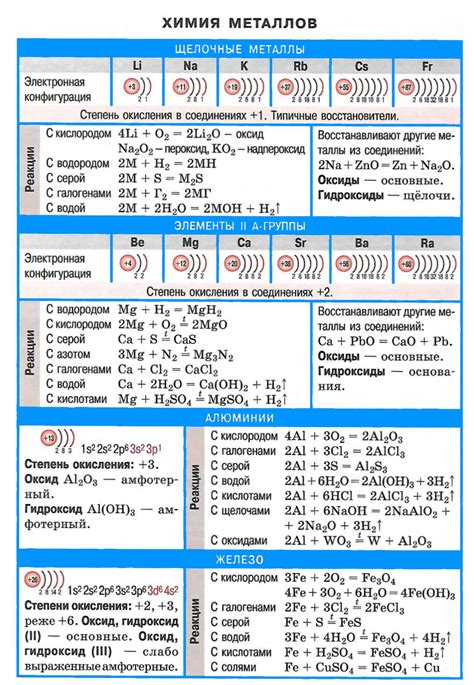
Химические свойства металлов в кислотах

Металлы взаимодействуют с кислотами, образуя соли и выделяя водород. Это связано с их низкой электроотрицательностью и способностью отдавать электроны.
При взаимодействии металлов с кислотами происходит окислительно-восстановительная реакция. Металл отдает электроны, при этом окисляется, а кислород из кислоты принимает электроны и восстанавливается.
Кислоты могут быть сильными или слабыми, и это влияет на скорость и интенсивность реакции. Сильные кислоты, такие как соляная или серная, обычно быстро реагируют с металлами, при этом выделяется большое количество водорода и образуются соли.
Некоторые металлы, такие как мышьяк или алюминий, взаимодействуют с кислотами очень медленно или не взаимодействуют вообще. Это связано с защитной пленкой оксида, которая образуется на их поверхности и предотвращает дальнейшую реакцию с кислотами.
Однако некоторые металлы, такие как цинк или железо, реагируют с кислотами очень активно и могут даже вызывать сильное плавление реакционной смеси или выделение большого количества пены.
Реакция металлов с кислотами широко применяется в различных областях, например, для получения солей или в процессе коррозии металлов. При этом важно учитывать конкретные химические свойства металла и кислоты, чтобы правильно выбирать условия реакции и контролировать процесс.
Химические свойства металлов в щелочах
Металлы обладают химическими свойствами, позволяющими им взаимодействовать с различными веществами. В частности, металлы проявляют активность во взаимодействии с щелочами – особыми щелочными растворами, содержащими гидроксиды щелочных металлов.
Щелочи способны реагировать с металлами, образуя гидроксиды. При этом реакция проходит с выделением водорода и образованием солей. Например, если в раствор гидроксида натрия (NaOH) поместить кусочек металла алюминия (Al), то произойдет реакция, в результате которой образуется гидроксид алюминия (Al(OH)3) и выделяется водород (H2).
Реакция металлов с щелочами характеризуется сильным окислительным свойством щелочей, которое проявляется в способности отнимать электроны от металлов. Это свойство щелочей объясняет их способность коррозировать металлы при взаимодействии.
Однако не все металлы одинаково активны в реакции с щелочами. Активность металлов зависит от их электрохимического потенциала. Наиболее активные металлы – щелочные металлы (литий, натрий, калий и др.), которые легко реагируют с гидроксидами щелочей, высвобождая водород. Металлы, такие как алюминий, железо и цинк, также реагируют с гидроксидами, но их реактивность ниже, чем у щелочных металлов.
Взаимодействие металлов с щелочами является одним из важных аспектов изучения химических свойств металлов и имеет практическое значение в различных отраслях, включая металлургию, энергетику, химическую промышленность и технику.
Химические свойства металлов как катализаторов

Металлы обладают уникальной способностью выступать в роли катализаторов во многих химических реакциях. Каталитические свойства металлов основаны на их способности изменять активность электронов и образовывать промежуточные соединения с реагентами.
Одним из основных способов каталитического действия металлов является активация химических связей в реагентах. Металлы могут служить центрами активации, на поверхности которых происходят важные химические превращения. Они могут изменять энергетический барьер реакции, ускорять скорость реакции или изменять хемоселективность реакции.
Металлы могут также образовывать комплексы с реагентами, стабилизируя промежуточные соединения и способствуя образованию конечных продуктов реакции. Каталитическое действие металлов может проявляться как в гомогенных, так и в гетерогенных реакциях.
Важным примером особо активных катализаторов являются нобелевские металлы, такие как платина, родий и палладий. Они обладают высокой электроными, кислотно-основными и геометрическими свойствами, что позволяет им эффективно катализировать множество химических реакций.
Каталитические свойства металлов широко применяются в промышленности, особенно в производстве неорганических и органических соединений. Они играют важную роль в синтезе пластиков, лекарств и многих других продуктов. Использование металлов как катализаторов способствует более эффективным и экологически безопасным методам производства.
Вопрос-ответ

Какие общие химические свойства металлов существуют?
У металлов есть несколько общих химических свойств. Во-первых, металлы хорошие проводники электричества и тепла. Они обладают высокой электропроводностью благодаря свободным электронам в своей кристаллической структуре. Во-вторых, металлы обычно реагируют с кислородом, образуя оксиды. Это происходит благодаря тому, что металлы имеют низкую ионизационную энергию и легко отдают свои электроны. Кроме того, металлы могут образовывать ионы, имеющие положительный заряд, когда они реагируют с другими веществами.
Как металлы проявляют свою реакцию с кислородом?
Металлы проявляют свою реакцию с кислородом путем образования оксидов. Когда металлы вступают в контакт с кислородом, они теряют свои электроны и окисляются. Это приводит к образованию оксидов металлов. Примером такой реакции может быть горение магния, при котором магний реагирует с кислородом воздуха и образует магниевый оксид. Эта реакция сопровождается выделением яркого пламени и образованием белого порошка - дыма.
Чем обусловлена высокая электропроводность металлов?
Высокая электропроводность металлов обусловлена наличием свободных электронов в их кристаллической структуре. В отличие от неметаллов, у металлов свободные электроны могут свободно перемещаться по металлической решетке без сопротивления. Ионные связи, которые удерживают электроны в неметаллах, отсутствуют у металлов. Поэтому металлы легко проводят электричество.
Почему металлы имеют положительный ионный заряд?
Металлы имеют положительный ионный заряд из-за потери своих электронов при реакциях. Это связано с их низкой ионизационной энергией. При взаимодействии с другими веществами, металлы отдают свои электроны и образуют положительно заряженные ионы. Например, натрий образует ион Na+, а алюминий образует ион Al3+. Они имеют положительный заряд в результате потери электронов.
