Химия - один из основных предметов в школьной программе, который изучается с 8 по 11 класс. Знания, полученные в ходе этого изучения, позволяют учащимся разобраться в различных законах и принципах химических реакций. В 11 классе особое внимание уделяется изучению свойств и химическим реакциям металлов - одной из самых распространенных групп химических элементов.
Металлы - это вещества с высокой теплопроводностью, электропроводностью и металлическим блеском. Они широко применяются в промышленности, строительстве, электронике и других отраслях. Презентация по химии в 11 классе дает учащимся возможность углубить свои знания о металлах и их свойствах, а также понять, как они взаимодействуют с другими веществами.
В ходе презентации ученики узнают о различных способах получения металлов, таких как плавка руды и электролиз. Они обсудят свойства различных металлов, их способность окисляться и восстанавливаться, а также их роль в химических реакциях. Презентация также охватывает различные сплавы, которые широко применяются в индустрии и имеют улучшенные свойства по сравнению с чистыми металлами.
Цель и задачи презентации по химии

Целью данной презентации является ознакомление учащихся 11 класса с основными понятиями и свойствами металлов, а также их применением в различных сферах человеческой деятельности.
Задачи презентации:
- рассмотреть структуру атома и уровни его организации;
- изучить то, что металлы представлены в периодической системе, их химические свойства;
- ознакомиться с методами получения металлов;
- раскрыть применение металлов в разных отраслях промышленности;
- изучить важность и опасность реакций металлов с окружающей средой;
- обсудить перспективы использования новых материалов на основе металлов;
- провести эксперименты, демонстрирующие свойства металлов.
Презентация будет содержать иллюстрации, графики, таблицы и анимации, чтобы дополнительно наглядно продемонстрировать рассматриваемые свойства и применение металлов. Кроме того, будет предложено учащимся активно участвовать в дискуссиях и задавать вопросы, чтобы расширить их понимание темы и стимулировать исследовательский интерес к химии.
Металлы в химии

Металлы - это особая группа химических элементов, которые обладают рядом уникальных физических и химических свойств. Они имеют высокую теплопроводность и электропроводность, гибкость, пластичность, и являются отличными носителями тепла и электричества.
В химии металлы широко используются благодаря своей реакционной способности. Они могут образовывать ионы положительной заряды, входя в химические реакции с другими веществами. Также металлы могут образовывать сплавы, что делает их идеальным материалом для производства различных изделий.
Металлы имеют разнообразные применения в нашей жизни. Например, железо используется для строительства и производства различных металлических изделий, алюминий применяется в авиации и строительных материалах, медь используется в электротехнике и изготовлении монет. Также металлы используются в производстве автомобилей, бытовой техники, медицинских инструментов и многого другого.
Отдельно стоит отметить особенности химических свойств металлов. Они обладают способностью образовывать оксиды, гидроксиды и соли. Некоторые металлы способны вступать в реакции с кислотами, образуя соли и выделяя водород. Также металлы могут проявлять амфотерность - способность взаимодействовать с кислотами и щелочами.
В качестве дополнительной информации, приведенной в виде списка, можно назвать некоторые из самых распространенных металлов:
- Железо
- Алюминий
- Медь
- Свинец
- Цинк
- Никель
Это лишь небольшая часть металлов, которые широко известны и используются в промышленности и повседневной жизни.
Определение и классификация металлов
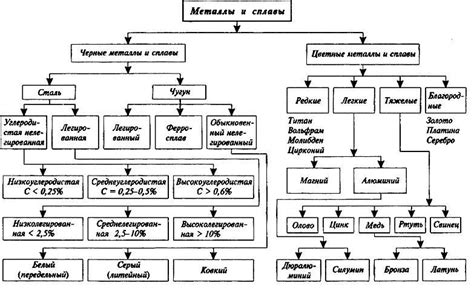
Металлы - это группа химических элементов, обладающих определенными физическими и химическими свойствами. Они обычно обладают металлическим блеском, являются хорошими проводниками электричества и тепла, обладают высокой пластичностью и способностью образовывать ионы положительных зарядов.
Металлы классифицируются по различным критериям. Одним из наиболее распространенных способов классификации металлов является деление их на черные, цветные и благородные металлы.
Черные металлы - это металлы, характеризующиеся высокой прочностью и термической устойчивостью. Они обладают черным или темным цветом, что связано с их оптическими свойствами. Примерами черных металлов являются железо, сталь, никель и чугун.
В свою очередь, цветные металлы имеют ярко выраженный цвет и обладают высокой пластичностью. Некоторые из них также обладают химической инертностью и устойчивостью к коррозии. Чистые цветные металлы встречаются редко в природе; обычно они входят в состав сплавов. Примерами цветных металлов могут служить медь, алюминий, свинец и цинк.
Наконец, благородные металлы - это самые неактивные металлы, характеризующиеся высокой стойкостью к коррозии и реакциями с другими веществами. Они представляют собой драгоценные металлы и широко используются в ювелирной промышленности и при производстве электроники. Примерами благородных металлов являются золото, серебро и платина.
Реакции металлов

Металлы обладают высокой реакционной способностью и способны вступать во многие химические реакции. Эти реакции могут происходить с различными веществами, включая кислоты, основания и соли.
Одной из наиболее известных реакций металлов является реакция с кислотами. Например, металлы реагируют с соляной кислотой, выделяя водородный газ и образуя соль. Реакция цинка с соляной кислотой протекает следующим образом:
Zn + 2HCl → ZnCl2 + H2
Также металлы могут реагировать с основаниями, образуя соответствующие соли. Например, натрий реагирует с гидроксидом натрия:
2Na + 2NaOH → 2Na2O + H2O
Металлы также реагируют с солями и образуют другие соли. Например, реакция железа с сульфатом меди:
Fe + CuSO4 → FeSO4 + Cu
Некоторые металлы обладают способностью к окислению и вступают в реакции с кислородом воздуха. Например, реакция железа с кислородом приводит к образованию ржавчины:
4Fe + 3O2 → 2Fe2O3
Реакции металлов могут иметь различную интенсивность и скорость протекания. Эти реакции применяются в промышленности и в нашей повседневной жизни для получения различных продуктов и материалов, а также для осуществления различных технологических процессов.
Окисление и восстановление металлов
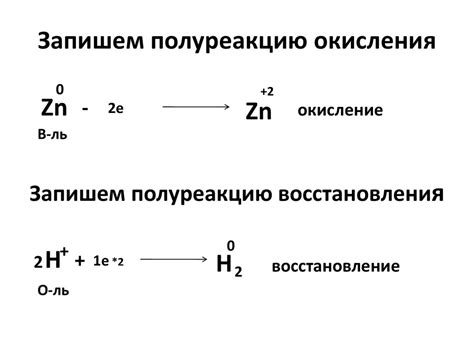
Окисление и восстановление металлов являются важными химическими процессами, которые происходят в реакциях металлов с окислителями или восстановителями. Окисление металлов происходит, когда металл отдает электроны, а восстановление металлов – когда металл принимает электроны.
Окисление металлов может происходить как в воздухе, так и в водной среде. При окислении металла создается оксид металла, который может быть в твердом или газообразном состоянии. Примером окисления металла воздухом является образование ржавчины на поверхности железа.
Восстановление металлов противоположно окислению и происходит при вступлении металла в реакцию с веществами, способными отдавать электроны. Металл при этом принимает электроны, что приводит к образованию положительно заряженного иона металла.
Окисление и восстановление металлов широко используются в промышленности и научных исследованиях. Например, в электрохимических процессах, таких как гальваническое покрытие и аккумуляторы, используется принцип восстановления металлов.
Окисление и восстановление металлов также играют важную роль в жизни организмов. Некоторые биологические процессы, такие как дыхание и фотосинтез, основаны на окислении и восстановлении металлов, таких как железо и магний, в органических молекулах.
Свойства металлов

Проводимость электричества и тепла: Металлы обладают высокой электрической и тепловой проводимостью. Это связано с наличием свободных электронов в их структуре. Благодаря этим свойствам металлы широко используются в электрических цепях, проводах, а также в производстве обогревательных элементов.
Пластичность и формовательность: Металлы можно превратить в различные формы путем давления или сплавления благодаря их пластичности и формовательности. Многие металлы могут быть прокатаны, отчеканены или вытянуты в тонкую проволоку. Это свойство позволяет использовать металлы в производстве различных изделий и конструкций.
Химическая активность: Металлы, как правило, обладают химической активностью, проявляемой в реакциях с кислородом, кислотами, водой и другими веществами. Некоторые металлы, такие как натрий или калий, очень реактивны и могут реагировать с воздухом, зажигаясь при контакте с ним. В то же время, некоторые металлы, например золото или платина, очень устойчивы к воздействию химических веществ и проявляют низкую химическую активность.
Металлы в производстве: Металлы широко используются в различных отраслях производства, таких как машиностроение, строительство, электротехника и т.д. Благодаря своим свойствам, металлы обеспечивают прочность, устойчивость и функциональность изделий. Они также играют важную роль в развитии науки и технологий, в том числе в производстве современных электронных устройств или материалов для авиации и космической промышленности.
Проводимость, пластичность и тугоплавкость металлов

Одним из характерных свойств металлов является их высокая проводимость, то есть способность проводить электрический ток. Это свойство объясняется структурой металлической решетки, в которой атомы металла образуют электронный газ. Электроны в этом газе могут свободно двигаться, что обеспечивает хорошую проводимость металлов.
Пластичность – это способность металлов деформироваться без потери прочности и разрушения. Именно благодаря этому свойству металлы применяются в различных отраслях промышленности. Они могут быть раскатаны в тонкую проволоку, протянуты в лист или прокатаны в сложные формы. Пластичность зависит от структуры металла, его температуры и применяемой силы.
Тугоплавкость представляет собой свойство металлов с высокой температурой плавления. Металлы имеют различную тугоплавкость. Некоторые металлы, такие как серебро или золото, имеют низкую температуру плавления, тогда как другие, например, железо или алюминий, имеют более высокую температуру плавления. Высокая тугоплавкость позволяет металлам выдерживать высокие температуры без их расплавления или испарения.
Применение металлов

1. Металлы в строительстве:
- Сталь широко применяется для изготовления несущих конструкций зданий и сооружений.
- Алюминий используется в строительстве для создания легких и прочных конструкций, таких как оконные рамы, входные двери и фасады зданий.
- Медь используется для проведения электрического тока в электропроводке зданий.
2. Металлы в автомобильной промышленности:
- Сталь широко применяется для изготовления кузовных деталей, рам автомобилей и других элементов конструкции.
- Алюминий используется для создания легких деталей, таких как бамперы и диски.
- Магний применяется для изготовления легких и прочных деталей двигателей и подвески автомобилей.
3. Металлы в электронике:
- Медь используется для изготовления проводников, печатных плат и других элементов электронных устройств.
- Алюминий применяется в качестве материала для радиаторов охлаждения электронных компонентов.
- Золото используется для создания контактов в электрических разъемах, так как оно имеет высокую электропроводность и химическую стойкость.
4. Металлы в медицине:
- Титан широко применяется в ортопедии для изготовления имплантатов, так как он обладает высокой прочностью и совместимостью с тканями организма.
- Серебро используется в антисептических средствах и повязках, так как оно обладает антибактериальными свойствами.
- Железо является основным компонентом гемоглобина, который необходим для транспортировки кислорода в организме.
5. Металлы в пищевой промышленности:
- Алюминий используется для изготовления упаковки для пищевых продуктов, такой как баночки и фольга. Он обладает высокой прочностью и защищает продукты от внешних воздействий.
- Нержавеющая сталь применяется для изготовления посуды, так как она не взаимодействует с пищей и обладает высокой стойкостью к коррозии.
- Свинец используется для создания пломб открытых банок и герметичной упаковки.
6. Металлы в производстве энергии:
- Уран и плутоний используются в ядерной энергетике для производства электроэнергии.
- Алюминий используется для изготовления оболочек тепловых элементов в ядерных реакторах.
- Медь применяется в электростанциях для передачи электрического тока.
Вопрос-ответ

Какие металлы являются самыми распространенными в природе?
Самыми распространенными металлами в природе являются железо, алюминий, медь, свинец, цинк и никель.
Какие физические свойства металлов следует упомянуть при подготовке презентации?
При подготовке презентации по химии о металлах, важно упомянуть следующие физические свойства: высокую электропроводность, теплопроводность и сжимаемость, блеск, способность образовывать сплавы и легко обрабатываться.
Какие примеры металлов можно привести в презентации?
В презентации можно привести примеры следующих металлов: железо, алюминий, медь, свинец, цинк, никель, золото, серебро, платина и титан.
