Металлы – это одна из основных групп химических элементов, которые обладают рядом уникальных свойств и широко используются в промышленности и повседневной жизни. Однако, чтобы правильно использовать металлы и избежать непредвиденных последствий, необходимо знать основные правила их химических свойств.
Первое правило заключается в том, что металлы обладают высокой электропроводностью. Это связано с наличием свободных электронов в их атомной структуре, которые легко перемещаются между атомами. Благодаря этому, металлы способны проводить электрический ток и являются основными материалами для производства электрических проводов и контактов.
Второе правило состоит в том, что металлы обладают высокой теплопроводностью. Это свойство объясняется тем, что свободные электроны в металлах также способны быстро передавать тепловую энергию между атомами. Благодаря этому, металлы используются в производстве теплоотводов, радиаторов и прочих устройств, предназначенных для отвода тепла.
Третье правило – металлы обладают высокой пластичностью и обрабатываемостью. Это связано с их способностью идеально соединяться друг с другом и образовывать различные сплавы. Благодаря высокой пластичности, металлы могут быть легко подвергнуты тяге, ковке и прокатке, что позволяет получать из них различные изделия и детали, такие как провода, листы, трубы и т.д.
И наконец, четвертое правило заключается в том, что металлы способны образовывать окислы. Окислы – это химические соединения, которые образуются при взаимодействии металлов с кислородом или другими химически активными веществами. Окислы могут иметь различные цвета и свойства, и они являются основной причиной коррозии металлов, поэтому важно принимать меры для защиты металлических изделий от окисления.
Правила взаимодействия металлов с кислотами

Металлы проявляют различную химическую активность при взаимодействии с кислотами. Основным правилом является то, что активность металла зависит от его положения в ряду напряжения металлов. Чем выше в ряду находится металл, тем больше он активен и быстрее реагирует с кислотой.
Наиболее активные металлы, такие как натрий, калий и кальций, реагируют с кислотами быстро и образуют соли и водород. Результатом их взаимодействия с кислотами является выделение пузырей газа.
Менее активные металлы, такие как цинк и железо, также реагируют с кислотами, но уже не так быстро. Они образуют соли, при этом выделяется водородный газ. Результатом взаимодействия меди и серебра с кислотами является образование соответствующих солей, однако выделение водородного газа при этом наблюдается в незначительных количествах.
Некоторые металлы, например, золото и платина, практически не реагируют с кислотами и поэтому считаются стабильными в отношении кислотного окружения.
Реакции металлов с щелочами и основаниями
Щелочи и основания – это химические соединения, которые обладают щелочными свойствами и способны образовывать ионы гидроксидов (OH-). Такие соединения являются сильными основами.
Многие металлы реагируют с щелочами и основаниями, образуя гидроксиды металлов.
Реакции металлов с щелочами и основаниями могут происходить следующим образом:
- Металл + щелочь → гидроксид металла + водород
- Металл + основание → гидроксид металла + водород
Некоторые металлы, такие как натрий и калий, реагируют с водой, образуя гидроксиды металлов и водород:
- 2Na + 2H₂O → 2NaOH + H₂
- 2K + 2H₂O → 2KOH + H₂
Другие металлы, например, магний и алюминий, реагируют с гидроксидами натрия или калия, образуя соответствующие гидроксиды металлов:
- Mg + 2NaOH → Mg(OH)₂ + Na₂
- 2Al + 6KOH → 2Al(OH)₃ + 3K₂
Реакции металлов с щелочами и основаниями являются одним из способов получения гидроксидов металлов, которые имеют широкое применение в различных областях науки и промышленности.
Важные факты о реакциях металлов с галогенами

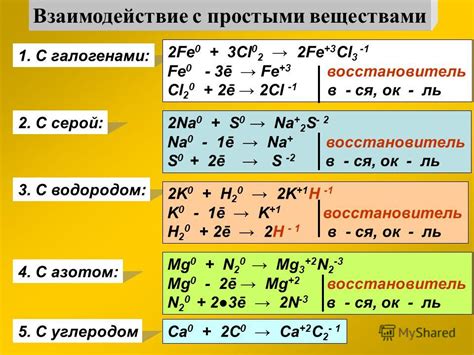
1. Образование солей: Металлы реагируют с галогенами (фтором, хлором, бромом и йодом) с образованием солей. Например, реакция натрия и хлора приводит к образованию хлорида натрия.
2. Образование ионов: В результате реакции металлов с галогенами, металлы переходят в ионы положительного заряда, а галогены — в ионы отрицательного заряда. Например, при взаимодействии кальция и хлора образуются катион кальция Ca2+ и анион хлорида Cl-.
3. Энергичность реакций: Реакции металлов с галогенами обычно проходят с выделением энергии и сопровождаются выделением тепла и света. Некоторые реакции могут быть очень энергичными и даже взрывоопасными.
4. Порядок реакций: Химическая активность галогенов увеличивается с увеличением их атомного номера в периоде таблицы Менделеева. Это означает, что реактивность металлов с галогенами также увеличивается при движении слева направо в периоде.
5. Отношение кислорода: Галогены, такие как хлор и бром, в реакциях с металлами сильно конкурируют с кислородом. Например, хлор может заменить кислород в оксиде меди, образуя галогенид меди.
6. Вещества с разными свойствами: Реакции металлов с галогенами могут приводить к образованию разных веществ с разными свойствами. Например, реакция железа с хлором приводит к образованию хлорида железа, который имеет зеленый цвет и используется в качестве органического катализатора.
7. Применение в промышленности: Галогены широко используются в промышленности для получения различных продуктов, таких как пластик, лекарственные препараты и смазки. Реакции металлов с галогенами являются важными этапами в процессах производства этих продуктов.
Металлы и их связь с кислородом

Металлы являются активными химическими элементами, которые образуют соединения с различными веществами, включая кислород. Взаимодействие металлов с кислородом может происходить при нагревании или взаимодействии с кислородными соединениями.
Когда металлы взаимодействуют с кислородом, они образуют оксиды. Оксиды металлов часто обладают характерной цветностью и физическими свойствами, такими как проводимость электричества и тепла.
Реакция металла с кислородом может быть энергичной и сопровождаться выделением большого количества тепла и света, как, например, при горении металлов в кислороде. Также металлы могут образовывать перекиси, когда каждый атом металла связан с двумя атомами кислорода.
Взаимодействие металлов с кислородом играет важную роль в промышленности и в природных процессах. Например, ржавление железа и стали является результатом окисления металла кислородом из воздуха. Это приводит к образованию оксида железа, который имеет характерную красноватую окраску.
Таким образом, взаимодействие металлов с кислородом является основой для понимания химических свойств металлов и их роли в различных процессах и явлениях.
Взаимодействие металлов с неорганическими соединениями
Металлы проявляют различные химические свойства при взаимодействии с неорганическими соединениями. Одним из наиболее распространенных типов взаимодействия является реакция металлов с кислотами. В результате этой реакции происходит выделение водорода и образование солей металлов.
Реакция металлов с основаниями также является важным типом взаимодействия. В этом случае металлы реагируют с основаниями, образуя соли и выделяя воду. Такие реакции широко применяются в промышленности и сельском хозяйстве.
Металлы также могут взаимодействовать с солями, образуя двойные замещения. В результате таких реакций может образовываться осадок или раствор. Это явление возможно благодаря различным степеням активности металлов.
Значительный интерес представляют реакции металлов с водой. Некоторые металлы могут взаимодействовать с водой, выделяя водород, в то время как другие металлы не реагируют с водой.
Все эти типы взаимодействия металлов с неорганическими соединениями являются основополагающими при изучении химических свойств металлов. Они демонстрируют разнообразие и важность взаимодействий металлов в природе и промышленности.
Возможные реакции металлов с органическими соединениями

Металлы могут проявлять активность при взаимодействии с органическими соединениями. В результате таких реакций может происходить образование новых соединений и изменение свойств металла. Самые распространенные реакции металлов с органическими соединениями включают горение или окисление органических соединений в присутствии металла.
Одним из примеров таких реакций является горение алканов в присутствии металлического натрия или калия. При этом образуется оксид металла и соответствующий алкан окисляется до алкена. Например, при взаимодействии натрия с пропаном образуется оксид натрия и пропен. Эта реакция является эндотермической и требует высокой температуры.
Еще одной распространенной реакцией является замещение атомов водорода в органических соединениях на металл. Например, при взаимодействии натрия с этиловым спиртом образуется натриевый этил, в котором атом водорода замещен на натрий. Такие реакции обычно протекают в присутствии растворителя, например, эфира или бензола.
Кроме того, некоторые металлы могут образовывать комплексные соединения с органическими лигандами. Например, железо может образовывать комплексы с цианидами или аммиаком. Эти соединения обладают специфическими свойствами и могут использоваться в различных областях, включая катализ химических реакций и медицину.
Физические свойства металлов и их использование в промышленности

Металлы обладают рядом уникальных физических свойств, которые делают их незаменимыми материалами в промышленности. Во-первых, металлы обладают высокой электропроводностью, что делает их идеальным материалом для производства электрических проводов, контактов и других электронных устройств.
Кроме того, металлы обладают высокой теплопроводностью, благодаря которой они широко используются в промышленности для изготовления теплообменных систем, радиаторов и других устройств, связанных с теплоотдачей и охлаждением.
Еще одной важной физической характеристикой металлов является их пластичность. Металлы можно легко деформировать и формировать, что позволяет создавать сложные конструкции и изделия. Благодаря этому свойству металлы широко применяются в автомобильной, аэрокосмической и многих других отраслях промышленности.
Не менее важным свойством металлов является их прочность и износостойкость. Металлические материалы обладают высокой механической прочностью, что позволяет им выдерживать большие нагрузки и длительное время сохранять свои свойства. Благодаря этим свойствам, металлы используются в строительстве, машиностроении, производстве оружия и многих других отраслях промышленности.
В целом, физические свойства металлов делают их одними из самых важных и востребованных материалов в промышленности. Они не только обеспечивают надежность и долговечность конструкций, но и позволяют разрабатывать новые технологии и совершенствовать уже существующие.
Влияние условий окружающей среды на химические свойства металлов

Химические свойства металлов сильно зависят от условий окружающей среды. Различные факторы, такие как влажность, температура, концентрация кислорода или других газов, а также наличие различных химически активных веществ могут значительно изменить поведение металлов.
Одним из факторов, который оказывает сильное влияние на химические свойства металлов, является влажность окружающей среды. Влажный воздух способствует коррозии многих металлов, таких как железо и его сплавы, алюминий и его сплавы, медь и другие металлы. В результате коррозии образуются оксиды металлов, что приводит к потере их механических и химических свойств.
Также температура может оказывать существенное влияние на химические свойства металлов. При нагревании металлы могут подвергаться окислению или редукции в зависимости от условий. К примеру, при нагревании железо в окружении кислорода, происходит образование ржавчины, которая является оксидом железа.
Наличие химически активных веществ также может значительно изменять химические свойства металлов. Взаимодействие металлов с кислотами, щелочами или солями приводит к образованию солей или соединений металлов с другими элементами. Это может изменить их физические и химические свойства, а также влиять на их реакционную способность.
Вопрос-ответ

Какие химические свойства металлов можно выделить?
У металлов есть ряд характерных химических свойств. Во-первых, они обладают высокой теплопроводностью и электропроводностью. Также они способны образовывать соли и основания. Кроме того, металлы обладают способностью взаимодействовать с кислородом, образуя оксиды. И, наконец, металлы могут реагировать с водой, образуя гидроксиды и выделяя водород.
Какие металлы считаются самыми реактивными?
Самыми реактивными металлами считаются щелочные и щелочноземельные металлы. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs), бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr) и барий (Ba). Они обладают высокой активностью и легко реагируют с кислородом, водой, кислотами и другими веществами. Эти металлы должны храниться в сухой среде, так как они реагируют с влагой в воздухе.
Какие металлы называют переходными?
В таблице периодических элементов второй и третий периоды, начиная со скандия (Sc), и четвертый и пятый периоды, начиная с иттрия (Y), находятся металлы, которые называют переходными. Эти металлы обладают особенными химическими свойствами и могут образовывать соединения с разными степенями окисления. Они обладают высокой плотностью, твердостью и точкой плавления, а также обладают способностью образовывать катионы с разной зарядностью.
