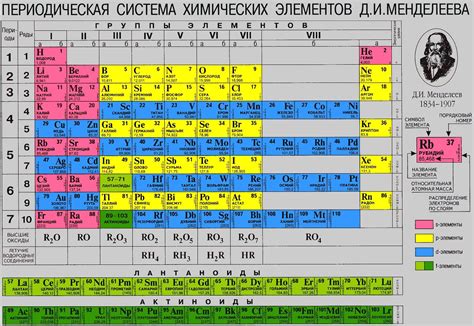
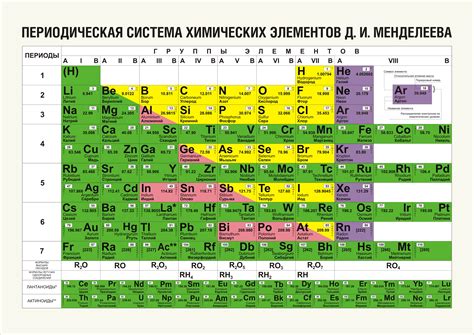
В таблице Менделеева существует множество элементов, но все они можно разделить на несколько классов. Одним из классов химических элементов являются металлы. Металлы обладают своеобразными свойствами: они хорошо проводят тепло и электричество, обычно твердые, обладают блестящей поверхностью и тяжелыми атомами.
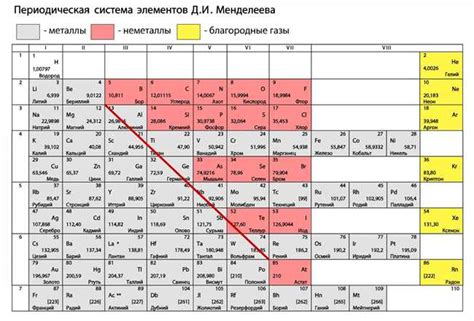
Однако есть и другой класс элементов - не металлы, которые имеют существенные отличия от металлов. Не металлы являются плохими проводниками электричества и тепла, часто имеют газообразное или жидкое агрегатное состояние при обычных условиях.
Существует несколько последовательностей элементов, которые не относятся к металлам. К ним относятся, например, водород, гелий, кислород, азот и фтор. Все эти элементы являются классическими примерами не металлов и имеют свои специфические свойства и применения в химии и промышленности.
Состав не металлов
Не металлы - это элементы, которые не обладают избыточным количеством электронов во внешней оболочке и не образуют положительно заряженных ионов. Они находятся на правой стороне периодической таблицы элементов и включают в себя такие элементы, как углерод, кислород, фосфор, сера и многие другие.
В таблице Менделеева не металлы представлены следующими элементами: водород, углерод, азот, кислород, фосфор, сера, селен, иод и свинец. Эти элементы обладают разнообразными свойствами и играют важную роль в химических реакциях и процессах, происходящих в природе и живых организмах.
Не металлы могут образовывать различные соединения, включая кислоты, оксиды, галогениды и многие другие. Например, кислород является основным компонентом воздуха и необходим для дыхания живых организмов, а сера используется в производстве удобрений и нефтепродуктов.
Учитывая свою химическую активность и разнообразие свойств, не металлы играют важную роль во многих отраслях науки и промышленности. Изучение этих элементов позволяет более полно понять их влияние на окружающую среду и разработать новые материалы и технологии для улучшения нашей жизни.
Водород и его роль

Водород - это химический элемент, который не относится к металлам. Он является самым легким и распространенным элементом во Вселенной. Водород имеет один электрон и одну протон в своем атоме.
Водород широко используется в различных отраслях промышленности и науки. Он является важным компонентом в производстве аммиака, который используется для производства удобрений. Водород также используется в процессе гидрогенизации, который позволяет получать различные химические соединения.
Водород играет роль в процессе синтеза ядерной энергии. В ядерной фузии водорода образуется гелий и большое количество энергии. Этот процесс происходит в солнце и других звездах. Ученые пытаются повторить этот процесс на Земле в контролируемых условиях для получения чистой источника энергии.
Водород также является перспективным источником энергии в виде водородных топливных элементов. Такие элементы могут использоваться в автомобилях и других устройствах как альтернатива ископаемым видам топлива. Водородные топливные элементы обеспечивают высокую энергоэффективность и не выделяют вредных выбросов в атмосферу.
Таким образом, водород играет важную роль в различных сферах нашей жизни, от промышленности до энергетики, и имеет потенциал быть ключевым элементом будущих технологий.
Группа галогенов
Галогены - это химическая группа неметаллов, включающая в себя флуор, хлор, бром, йод и астат. Они являются частью седьмой группы периодической системы элементов.
Галогены обладают высокой реактивностью и образуют соединения с другими элементами, как металлическими, так и неметаллическими. Они обладают сильным окислительным действием и могут выступать как окислители во многих химических реакциях.
В природе галогены встречаются в виде их хлоридов, бромидов, йодидов и фторидов. Они широко используются в химической промышленности, медицине, электронике и других областях.
- Флуор является самым реактивным и электроотрицательным элементом среди галогенов.
- Хлор применяется в производстве пластиков, рубероида, резины и других полимерных материалов.
- Бром используется для производства хлорбромидной резины, огнезащитных веществ и барвников.
- Йод находит применение в медицине, производстве обеззараживающих средств и фотографии.
- Астат встречается в природе в крайне малых количествах и имеет очень короткий период полураспада.
Галогены также образуют соли с щелочными металлами, которые называются галоидами. Например, хлорид натрия и бромид калия - это распространенные галоиды, используемые в пищевой промышленности и в качестве консервантов.
Кислород и его оксиды
Кислород (O) - химический элемент группы 16 (VIA) периодической системы, относящийся к неметаллам. Он характеризуется высокой электроотрицательностью и образует множество соединений с другими элементами.
Одним из наиболее известных соединений кислорода является вода (H2O). Вода состоит из двух атомов водорода и одного атома кислорода, связанных ковалентной связью. Это самое распространенное соединение кислорода и является необходимым для жизни на Земле.
Кроме воды, кислород образует оксиды, которые являются соединениями с кислородом в составе. Некоторые из этих соединений имеют кислотные свойства и называются оксокислотами.
Одним из известных оксидов кислорода является углекислый газ (CO2). Углекислый газ образуется при сгорании органического вещества или дыхании живых организмов. Он является главным газовым компонентом атмосферы Земли и играет важную роль в глобальном потеплении.
Еще одним оксидом кислорода является двуокись азота (NO2). Этот газ имеет красно-коричневый цвет и образуется при сгорании топлива. Двуокись азота является загрязняющим веществом и может вызывать проблемы с дыханием и сердечно-сосудистой системой у людей.
Группа галогенов и группа азота

Группа галогенов – это элементы VII группы периодической системы, которые обладают характерными свойствами. К группе галогенов относятся фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At). Эти элементы являются неметаллами и обладают высокой реакционной способностью.
Галогены образуют ионные связи с металлами, а также молекулярные соединения с другими неметаллами. Они обладают высоким электроотрицательностями, что обуславливает их сильное окислительное действие. Галогены относятся к самым электроотрицательным элементам в периодической системе.
Группа азота – это элементы V группы периодической системы, к которой относятся азот (N), фосфор (P), мышьяк (As), антимон (Sb) и бисмут (Bi). Эти элементы также являются неметаллами и обладают своими характерными свойствами.
Азот является самым распространенным элементом в атмосфере Земли. Он обладает высокой стабильностью и не реагирует с агрессивными средами. Фосфор используется в различных видах промышленности, включая производство удобрений. Мышьяк и антимон имеют схожие свойства и используются во многих отраслях промышленности.
Бисмут – самый тяжелый элемент группы азота и обладает металлическими свойствами. Он часто используется для производства лекарств и сплавов с другими металлами. Как и другие неметаллы группы азота, бисмут является токсичным в больших дозах и может оказывать вредное воздействие на здоровье человека.
Вещества с атомами фосфора и серы

Фосфор (P) и сера (S) являются не металлами и обладают различными физическими и химическими свойствами.
Фосфор – химический элемент с атомным номером 15. Он обладает высокой реакционной способностью и способен образовывать различные соединения с другими элементами. Например, в природе наиболее распространенным соединением фосфора является фосфат кальция, который составляет основную часть костей и зубов у людей и животных. Фосфор также широко используется в промышленности для производства удобрений, пестицидов и прочих химических веществ.
Сера – химический элемент с атомным номером 16. Она обладает хорошей термической и электрической проводимостью. Сера может образовывать различные соединения, включая серный диоксид (SO2) и серную кислоту (H2SO4). Сера также находит применение в производстве резины, бумаги, пластмасс и других материалов.
Вещества, содержащие атомы фосфора и серы, могут образовывать разнообразные соединения, такие как фосфиды и сульфиды. Фосфиды – это бинарные соединения фосфора с другими элементами, образующие кристаллические структуры. Сульфиды – это бинарные соединения серы с другими элементами, которые характеризуются различными физическими и химическими свойствами.
Итак, вещества с атомами фосфора и серы представляют широкий класс химических соединений, которые находят применение в различных областях, таких как медицина, сельское хозяйство, промышленность и др.
Группа инертных газов и азот

Группа инертных газов состоит из элементов, которые характеризуются высокой степенью стабильности и низкой активностью химической реакции. В эту группу входят гелий, неон, аргон, криптон, ксенон и радон. Инертные газы обладают полной внешней электронной оболочкой, благодаря чему они не образуют химических соединений с другими элементами.
Гелий является легким инертным газом, без цвета и запаха. Он имеет низкую плотность и высокую температуру кипения. Гелий широко используется в научных и технических целях, в том числе в аэростатике, при производстве сверхпроводников, в медицине.
Элемент неон обладает красным оранжевым цветом, является самым легким из газов. Он применяется в световой рекламе, в лазерных устройствах и в некоторых видеоэкранах.
Аргон относится к инертным газам, имеет бесцветный и безвкусный газ. Аргон используется в осветительных средствах, в технике сварки и в процессах чистки металлов.
Криптон является редким инертным газом. Он обладает бледно-желтым свечением при разряде, используется в световой технике, в том числе в летательной стрелке, а также в лазерных приборах.
Ксенон - инертный газ, обладающий голубоватым свечением. Ксенон используется в осветительной технике, в автомобильной промышленности и в медицине.
Радон является самым тяжелым инертным газом. Он обладает радиоактивными свойствами и служит причиной радоновых заболеваний. Радон используется в качестве источника излучения в некоторых научных исследованиях.
Вопрос-ответ

Какие элементы относятся к не металлам?
Элементы, которые относятся к не металлам, включают в себя водород, углерод, кислород, азот и многие другие. Их химические и физические свойства отличаются от металлов, они обычно не обладают блеском, не проводят ток и тепло плохо.
Каковы свойства не металлов?
Не металлы обычно обладают следующими свойствами: низкой теплопроводностью и электропроводностью, высоким электроотрицательностью, низким плавлением и кипением, твердыми, хрупкими или газообразными состояниями при комнатной температуре.
Какие последовательности элементов не относятся к металлам?
Не металлы могут быть найдены в разных последовательностях периодической системы элементов. Например, группа 17 (галогены) состоит из не металлов фтора, хлора, брома, йода и астатина. Есть также множество других последовательностей, в которых встречаются не металлы.