Электролиз — это процесс, при котором применяется электрический ток для разложения вещества на его составные части. В электролизе солей металлы возвращаются к исходному состоянию путем восстановления. Данный процесс осуществляется в электролитической ячейке, в которой находятся две электродных полуячейки, соединенные между собой через электролит. Одна полуячейка служит для окисления металла, а другая — для его восстановления.
Порядок восстановления металлов в электролизе их солей зависит от их электрохимического потенциала. Электрохимический потенциал металла определяет его склонность к окислению и восстановлению. Важно отметить, что восстановление металла происходит на катоде, который является отрицательно заряженным электродом, в то время как окисление происходит на аноде, положительно заряженном электроде.
Порядок восстановления металлов можно определить с помощью значения их стандартного окислительно-восстановительного потенциала. Величина стандартного потенциала характеризует скорость реакции окисления и восстановления металла. Металлы с более положительным потенциалом будут восстановлены раньше, чем металлы с более отрицательным потенциалом в данном электролите.
Электролиз и его роль в процессе восстановления металлов

Электролиз - это электрический процесс, который используется для разложения соединений на ионы с помощью электрического тока. В контексте процесса восстановления металлов из их солей, электролиз играет важную роль. Он позволяет получить металлы в чистом виде с высокой степенью чистоты.
В процессе электролиза металлы восстанавливаются из ионов, находящихся в растворе ионообменными процессами на поверхности электрода. Для электролиза используются специальные электролиты, содержащие соединения металлов. Важно отметить, что электролиты должны быть проводниками электрического тока, чтобы обеспечить движение ионов.
Процесс восстановления металлов в электролизе основан на том, что каждый металл имеет свой потенциал окисления и восстановления, который определяет его способность к электрохимическим реакциям. Металлы с более высоким значением потенциала окисления будут восстанавливаться раньше металлов с более низким значением.
Для проведения электролиза, необходимы электроды - анод и катод. В процессе восстановления металлов, анодом выступает металл, который будет растворяться, а катодом - металл, который будет восстанавливаться. При подаче электрического тока на электроды происходят реакции окисления на аноде и восстановления на катоде, что приводит к разделению металлических ионов на их элементарные составляющие.
Электролиз широко применяется в промышленности для получения металлов высокой чистоты. Этот процесс также используется в химических лабораториях для изучения электрохимических свойств металлов и получения их соединений. Восстановление металлов в электролизе является важным исследовательским и техническим методом, который позволяет получить металлы с требуемыми характеристиками и качеством.
Электролиз как метод восстановления металлов
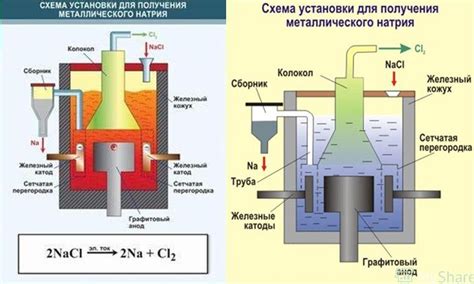
Электролиз солей металлов является одним из эффективных методов восстановления металлов. Он основан на использовании электрической энергии для процесса разложения солей металлов на составляющие их ионы.
Основная идея электролиза заключается в использовании электрического тока для переноса ионов металлов из раствора соли на электроды. При этом положительно заряженные ионы металла, называемые катионами, перемещаются к отрицательному электроду, а отрицательно заряженные ионы, или анионы, движутся к положительному электроду.
В процессе электролиза происходит восстановление металла на отрицательном электроде. Металл осаждается в виде нерастворимого осадка или покрывает поверхность электрода. При этом он выделяется из раствора и можно легко отделить от него. Электролиз позволяет получать металлы высокой чистоты, так как процесс происходит без примесей и применения химических реагентов.
Для электролиза необходимо использовать специальные электролиты, которые содержат соли металлов. В зависимости от цели процесса, можно изменять состав электролита и условия проведения электролиза, такие как температура, сила тока и время процесса. Электролиз используется в различных индустриальных процессах и научных исследованиях для получения металлов, очистки растворов от примесей и других применений.
Основные этапы электролиза

Электролиз – это процесс разложения вещества под воздействием электрического тока. В случае электролиза металлических солей, он осуществляется с использованием электролита – раствора соли, в котором находится электродная ванна.
Первый этап электролиза – подготовка электродной ванны. Для этого создается необходимая концентрация раствора соли, которая зависит от предполагаемого восстановления металла. Затем в раствор погружаются два электрода: анод и катод. Анод – это положительно заряженный электрод, на котором происходит окисление. Катод – отрицательно заряженный электрод, на котором происходит восстановление.
Второй этап – выполнение электролиза. При подключении электрического тока к аноду начинается процесс окисления. Ионы металла соединяются с анодом, при этом отдавая электроны. Полученные ионы металла переходят в раствор и находятся в окисленном состоянии. Основная реакция анода – окисление ионов металла:
2Mn+ → 2Mn2+ + 2e-При этом на катоде происходит противоположная реакция – ионы металла получают электроны и восстанавливаются, то есть переходят в нейтральное состояние. Процесс восстановления на катоде происходит в соответствии со следующей реакцией:
Mn2+ + 2e- → MnТаким образом, на катоде выпадает металл восстановленным состоянии, а на аноде происходит его окисление. Эти реакции позволяют осуществить разделение металла от его солей при электролизе.
Влияние солей на процесс восстановления
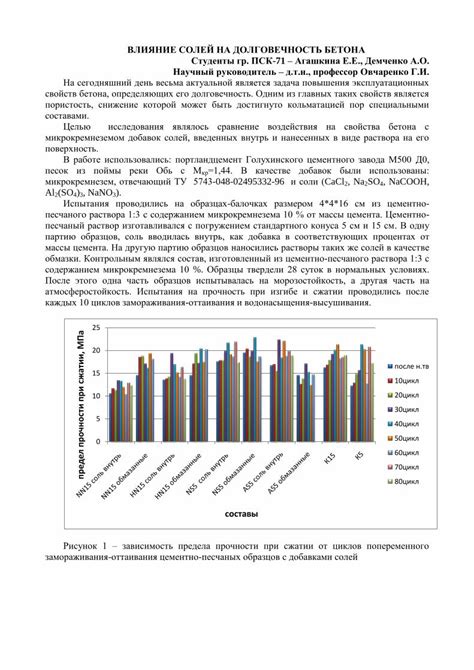
Процесс восстановления металлов в электролизе их солей напрямую зависит от характеристик и свойств солей, которые используются в данном процессе. Соли металлов могут оказывать как положительное, так и отрицательное влияние на эффективность восстановления.
Во-первых, концентрация солей играет важную роль. При низкой концентрации солей электролитический процесс может замедлиться, в связи с увеличением сопротивления среды. Однако, при слишком высокой концентрации солей, могут возникнуть проблемы связанные с концентрированием и загрязнением электролита. Оптимальная концентрация солей должна быть выбрана, исходя из требований процесса восстановления.
Во-вторых, тип соли имеет существенное значение. Некоторые соли обладают более высокой растворимостью, что упрощает процесс восстановления металла. Однако, другие соли могут искажать результат электролиза, например, засорять анод и катод отложением нерастворимых продуктов или вызывать нежелательные реакции. Поэтому, необходимо тщательно выбирать соли, исходя из требований и конкретных условий процесса восстановления.
Кроме того, влияние добавленных солей может изменяться в зависимости от pH среды. Изменение pH напрямую влияет на ионную активность и растворимость солей, что может повлиять на скорость и эффективность процесса восстановления металла.
Таким образом, выбор и оптимизация использования солей является важным аспектом при проведении электролиза солей металлов, так как они могут оказывать как положительное, так и отрицательное влияние на процесс восстановления.
Применение электролиза в промышленности
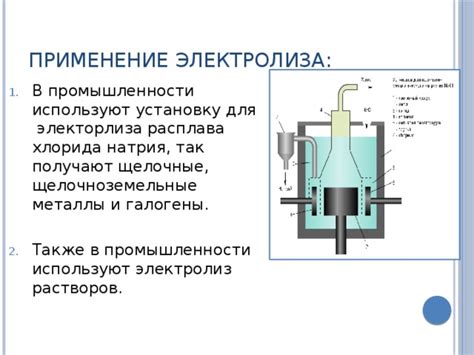
Электролиз является одним из основных процессов, применяемых в промышленности для получения различных металлов и химических соединений. Этот процесс основан на использовании электрической энергии для преобразования ионов растворенных веществ в металлы или другие продукты.
Главной областью применения электролиза в промышленности является производство алюминия. В процессе электролиза оксид алюминия (алюминий) разлагается на металлический алюминий и кислород. Этот процесс является энергозатратным и требует больших мощностей, однако алюминий является одним из самых востребованных металлов в промышленности.
Также электролиз широко применяется для получения цинка и свинца из их соответствующих солей. Эти металлы используются в различных областях промышленности, включая производство автомобилей, строительство и электротехнику.
Одной из важных областей применения электролиза является получение чистейшей водородной и кислородной газов. Водород используется как энергетическое топливо в различных отраслях, включая автомобильную промышленность и производство электричества. Кислород, в свою очередь, применяется в медицине и в процессах окисления органических веществ в различных промышленных процессах.
В области химической промышленности электролиз используется для получения различных веществ, таких как хлор и каустическая сода. Разложение хлорида натрия (соли) позволяет получить хлор и натрийгидроксид (каустическую соду). Эти вещества являются важными компонентами в производстве хлорсодержащих соединений и моющих средств.
Вопрос-ответ

Какие металлы можно восстановить из их солей электролизом?
Электролизом можно восстановить множество металлов, включая медь, серебро, золото, никель, цинк и другие. Возможность восстановления определенного металла зависит от его свойств и реакционной способности.
Каков порядок восстановления металлов в электролизе их солей?
Порядок восстановления металлов в электролизе их солей определяется их стандартным электродным потенциалом. Металлы с более низкими потенциалами восстанавливаются в первую очередь, а металлы с более высокими потенциалами остаются в ионной форме. Так, например, медь имеет более низкий потенциал, чем серебро и золото, поэтому она восстанавливается первой.
Какие факторы влияют на порядок восстановления металлов в электролизе их солей?
Помимо электродного потенциала, порядок восстановления металлов может быть также зависит от концентрации ионов металла в растворе, pH среды, температуры и других факторов. Например, при повышении pH среды, металлы с низкими потенциалами становятся менее растворимыми и восстанавливаются раньше.
Для чего используется электролиз ионных соединений металлов?
Электролиз ионных соединений металлов широко применяется в различных областях, включая металлургию, химическую промышленность и производство электроники. С его помощью можно получить высокочистые металлы, проводить гальваническое покрытие, выполнять электрохимические реакции и многое другое.
