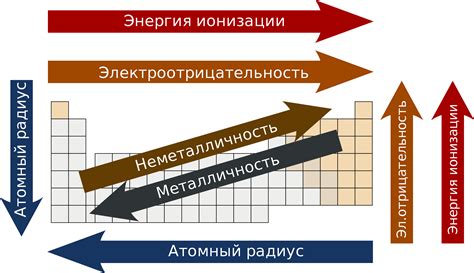
Атомный радиус является одной из важных характеристик атомов металлов. Он определяется как расстояние от центра ядра до наружного электрона. Атомный радиус может варьироваться в зависимости от различных факторов, таких как электронная конфигурация и электростатическое взаимодействие между атомами.
Возрастание атомного радиуса металлов имеет свою систематику. Обычно атомный радиус увеличивается вдоль периодической таблицы с верхнего левого угла к нижнему правому углу. Это связано с тем, что с увеличением атомного номера в периоде увеличивается количество электронов в атоме, что приводит к увеличению размеров атома.
Однако, есть исключения из этой общей закономерности. Например, металлы, относящиеся к блоку d (переходные элементы), имеют особенности в порядке возрастания атомного радиуса. Это связано с эффектом поглащения внутренних d-электронов электронами из s- и p-орбиталей, что приводит к сжатию размеров атома.
Связь атомного радиуса с химическими свойствами металлов
Атомный радиус металлов является одним из важнейших факторов, определяющих их химические свойства. Радиус атома металла оказывает влияние на его реакционную способность, способность образовывать связи с другими веществами и растворяться в различных средах.
В общем случае можно сказать, что с увеличением атомного радиуса металлов их химическая активность увеличивается. Это связано с тем, что в случае металлов более крупный атом легче отдает электроны в реакции, что делает его более реакционноспособным.
Также атомный радиус металлов оказывает влияние на их физические свойства. Например, с увеличением атомного радиуса металлов обычно увеличивается и их плотность, а также плавность и гибкость. Это связано с тем, что более крупные атомы имеют большую массу и более слабую связь с остальными атомами в кристаллической решетке, что делает металл более мягким и гибким.
Некоторые металлы имеют так называемые аллотропные модификации, то есть различные формы с разными атомными радиусами. Например, у железа существуют атмосферное железо и γ-железо, которые имеют разные размеры атомов и различные свойства. В таких случаях атомный радиус металла существенно влияет на его свойства и структуру кристаллической решетки.
В целом, атомный радиус металлов является важным параметром, определяющим их химические и физические свойства. Изменение радиуса металла может привести к изменению его реакционной способности, плотности, твердости и других характеристик. Поэтому, при изучении металлов и их свойств необходимо учитывать их атомные радиусы и их влияние на химическую и физическую реакционность.
Что такое атомный радиус
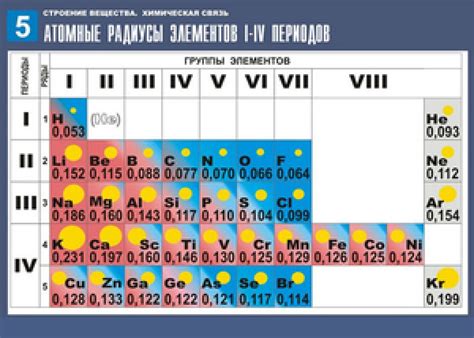
Атомный радиус - это характеристика атома, которая описывает его размер. Он определяется расстоянием между ядром атома и его внешней электронной оболочкой. Атомы металлов имеют больший атомный радиус по сравнению с другими элементами.
Атомный радиус металла зависит от его положения в периодической системе элементов. В периоде атомные радиусы обычно уменьшаются в общем случае отлево направо. Поэтому атомный радиус лития будет больше, чем у фтора в том же периоде.
В группе атомные радиусы обычно увеличиваются с увеличением атомного номера элемента. Это означает, что атомные радиусы элементов внутри одной группы будут увеличиваться по мере продвижения вниз по группе. Например, атомный радиус лития будет меньше, чем у цезия в той же группе.
Атомный радиус металлов имеет важное значение для их физических и химических свойств. Большой атомный радиус позволяет атомам металла иметь свободные электроны, что делает их хорошими проводниками электричества и тепла. Также атомный радиус влияет на силу взаимодействия атомов между собой, что влияет на их плотность и температуру плавления. Более маленький атомный радиус может привести к более прочным связям и более высоким температурам плавления.
Периодическая таблица и атомные радиусы
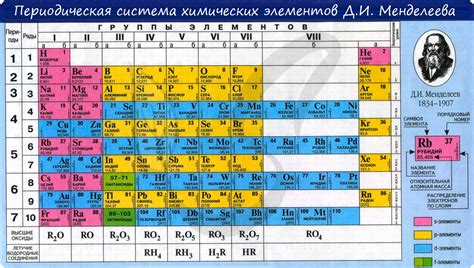
Периодическая таблица химических элементов является основным инструментом для изучения свойств и характеристик различных веществ. Она представляет собой удобную систему классификации элементов в соответствии с их атомными номерами и атомными массами. Одним из важных параметров, определяющих свойства элементов, является их атомный радиус.
Атомный радиус — это расстояние от ядра атома до его внешней электронной оболочки. Он является показателем размера атома и может варьироваться в зависимости от его положения в периодической таблице. Обычно атомы имеют наибольший размер внизу группы и наименьший размер вверху группы.
Атомные радиусы металлов в периодической таблице увеличиваются с лева на право в периоде и с верху вниз в группе. Это связано с изменением электронной конфигурации атомов и поведением их электронных оболочек. Верхние элементы группы имеют меньшее число электронных оболочек, поэтому их атомный радиус обычно меньше, чем у нижних элементов.
Атомные радиусы металлов можно представить в виде таблицы, где каждому элементу соответствует его атомный радиус. Такая таблица может включать элементы периодической таблицы и их соответствующие атомные радиусы. Это позволяет систематизировать информацию и сравнить размеры атомов различных металлов.
Изучение атомных радиусов металлов в периодической таблице позволяет понять, как различные факторы влияют на размеры атомов и связанные с этим свойства. Это может быть полезным при проведении химических реакций и изучении структуры и свойств различных материалов.
Порядок возрастания атомного радиуса

Атомный радиус - это характеристика атома, определяющая его размер. Знание порядка возрастания атомного радиуса металлов позволяет более точно предсказывать и объяснять различные химические свойства веществ.
Общий порядок возрастания атомного радиуса металлов идет вдоль периодической системы. По мере движения вдоль периодов от левого к правому краю, атомный радиус металлов сокращается. Это связано с тем, что в периоде с ростом заряда ядра идет симметричное увеличение количества электронов.
Однако, в пределах одного периода порядок возрастания атомного радиуса металлов может меняться. Например, в 4 периоде атомный радиус металлов возрастает по мере продвижения слева направо, однако сразу же уменьшается с появлением серии металлов-переходников.
Также, порядок возрастания атомного радиуса может быть связан с ионизацией атомов. В целом, ионизация происходит проще при большем размере атома. Поэтому, металлы с большим атомным радиусом имеют более низкую энергию ионизации.
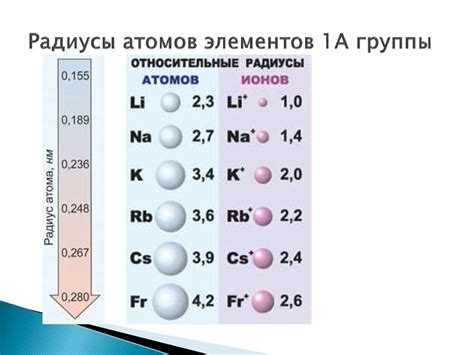
Для более наглядного представления порядка возрастания атомного радиуса металлов можно воспользоваться таблицей, в которой металлы расположены в порядке увеличения радиуса. Вот такая таблица:
| Металл | Атомный радиус (пм) |
|---|---|
| Литий (Li) | 152 |
| Натрий (Na) | 186 |
| Калий (K) | 203 |
| Рубидий (Rb) | 216 |
| Цезий (Cs) | 235 |
| Франций (Fr) | 260 |
Таким образом, важно учитывать порядок возрастания атомного радиуса металлов при изучении их химических свойств, а также в различных химических расчетах и прогнозах.
Зависимость атомного радиуса от структуры кристаллической решетки
Атомный радиус металлов связан с их структурой кристаллической решетки. Кристаллическая решетка представляет собой упорядоченное расположение атомов в кристалле, которая может иметь различные формы и структуры.
В металлической решетке атомы металла образуют кристаллическую сетку, в которой каждый атом окружен соседними атомами. Расстояние между атомами в кристаллической решетке определяет их радиус. Как правило, атомы в металлической решетке имеют одинаковый радиус, который зависит от типа металла и структуры кристаллической решетки.
Наиболее распространенные структуры кристаллической решетки у металлов - кубическая гранецентрированная (гцк), кубическая простая (цш) и гексагональная ближнепакованная (гбп). В гцк структуре атомы металла располагаются в узлах кубической сетки, а в гбп структуре атомы образуют плотную упаковку, располагаясь в слоях плоской шестиугольной решетки.
Зависимость атомного радиуса от структуры кристаллической решетки заключается в том, что различные структуры могут оказывать влияние на взаимное расположение атомов металла и, следовательно, на их радиусы. Например, в гцк структуре атомы металла можно представить как шары, упакованные в 3D-сетку, что приводит к большему расстоянию между атомами и, соответственно, большому атомному радиусу. В гбп структуре атомы упакованы ближе друг к другу, что приводит к меньшему расстоянию между ними и, следовательно, к меньшему атомному радиусу.
Влияние других факторов на атомный радиус металлов
Помимо периодической таблицы, атомный радиус металлов может быть также оказан влиянием других факторов, таких как:
- Валентность:
- Электронная структура:
- Тип кристаллической решетки:
- Степень окисления:
Чем ниже валентность металла, тем больше его атомный радиус. Это связано с тем, что при увеличении валентности происходит добавление электронов на внешние энергетические уровни, что приводит к сужению атомного радиуса.
У металлов, характеризующихся большим количеством электронов во внешней оболочке, обычно более маленький атомный радиус. Также сказывается влияние эффекта экранирования - наличие электронов внутренних оболочек не позволяет полностью ощутить заряд ядра.
Атомный радиус металлов также зависит от типа и структуры его кристаллической решетки. Например, в решетке, где металлы образуют гексагональную ближайшую упаковку, атомные радиусы будут отличаться от решетки с кубической фалающей косточки.
Существует связь между степенью окисления и атомным радиусом металлов. Обычно металлы с более высокой степенью окисления имеют более маленький атомный радиус, поскольку окиснение приводит к выходу электронов из внешней оболочки.
Таким образом, помимо расположения в периодической таблице, атомный радиус металлов может быть влиянием различных факторов, таких как валентность, электронная структура, тип кристаллической решетки и степень окисления.
Практическое применение знания о порядке возрастания атомных радиусов

Определение свойств материалов:
Знание порядка возрастания атомных радиусов металлов позволяет определить и предсказывать их химические и физические свойства. Больший атомный радиус, как правило, указывает на более слабую силу притяжения между атомами, что может влиять на их реакционную способность, температуру плавления и кристаллическую структуру.
Металлургия и сплавы:
Порядок возрастания атомных радиусов металлов имеет практическое значение при производстве сплавов. Например, при создании сплавов, таких как бронза или нержавеющая сталь, выбор металлов с схожими атомными радиусами может улучшить их структуру и механические свойства. Знание порядка атомных радиусов может помочь определить оптимальную комбинацию металлов для достижения желаемых характеристик сплава.
Магнитные свойства:
Атомные радиусы металлов также влияют на их магнитные свойства. Например, у некоторых металлов с более большим атомным радиусом могут быть более слабые магнитные свойства, чем у металлов с меньшим атомным радиусом. Знание порядка возрастания атомных радиусов позволяет предсказывать и объяснять различия в магнитных свойствах металлов.
Химические реакции:
Знание порядка возрастания атомных радиусов металлов также может помочь предсказать и объяснить химические реакции, особенно в случае образования ионов. Металлы с большим атомным радиусом, склонными отдавать электроны, будут иметь большую реакционную способность, в то время как металлы с меньшим атомным радиусом, склонными принимать электроны, будут иметь большую аффинность к электронам.
Электронные устройства:
Знание порядка возрастания атомных радиусов может быть полезно при выборе и проектировании материалов для использования в электронных устройствах. Металлы с определенными атомными радиусами могут обладать оптимальными свойствами для проводников, полупроводников или изоляторов в различных компонентах электроники.
Вопрос-ответ

Каким образом определяется атомный радиус металлов?
Атомный радиус металлов определяется исходя из размеров атомов, составляющих кристаллическую решетку металла.
Какие металлы имеют наибольший атомный радиус?
Наибольший атомный радиус имеют металлы на левом конце периодической системы, например, калий, цезий, франций.
Почему атомный радиус металлов увеличивается от верхушки периодической системы к ее низу?
Это связано с увеличением количества энергетических уровней и электронных оболочек у атомов металлов, расположенных ниже в периодической системе. Каждая новая электронная оболочка увеличивает общий размер атома и, следовательно, атомный радиус.
Как влияет заряд ядра на атомный радиус металлов?
Чем больше заряд ядра атома, тем сильнее притягиваются к нему электроны и тем меньше размер атома. Поэтому атомные радиусы металлов с увеличением заряда ядра уменьшаются.
Какие основные факторы влияют на изменение атомного радиуса металлов?
Основными факторами, влияющими на изменение атомного радиуса металлов, являются заряд ядра атома, количество электронных оболочек, количество электронов в атоме и их энергия.
