Mеталлы имеют различные степени способности к восстановлению - процессу восстановления потерянных электронов. Это явление играет важную роль во многих аспектах нашей жизни, включая промышленность и медицину. В данной статье рассмотрим порядок уменьшения восстановительных свойств у различных металлов.
Наиболее сильными восстановителями среди металлов являются активные металлы, такие как литий, натрий и калий. Они обладают способностью быстро отдавать электроны, что делает их хорошими анодами в различных электрохимических процессах. За ними следуют щелочноземельные металлы, такие как магний и кальций. Они также являются хорошими восстановителями, но их способность отдавать электроны несколько ниже, чем у активных металлов.
Далее в порядке уменьшения восстановительных свойств идут переходные металлы, такие как железо, медь и цинк. Они обладают средней способностью к восстановлению и широко используются в различных областях, включая строительство, автомобильную промышленность и электронику. В отличие от активных металлов, переходные металлы имеют различные степени окисления, что позволяет им проявлять разные восстановительные свойства в разных соединениях.
В конце списка находятся пассивные металлы, такие как золото, платина и серебро. Они обладают низкой способностью к восстановлению и часто используются в ювелирном искусстве, так как они стойки к коррозии и сохраняют свою блеск на протяжении длительного времени.
Итак, порядок уменьшения восстановительных свойств металлов следующий: активные металлы - щелочноземельные металлы - переходные металлы - пассивные металлы.
Знание порядка уменьшения восстановительных свойств металлов является важным в химических процессах и позволяет эффективно использовать их в различных сферах промышленности и науки.
Восстановительные свойства металлов и их порядок уменьшения

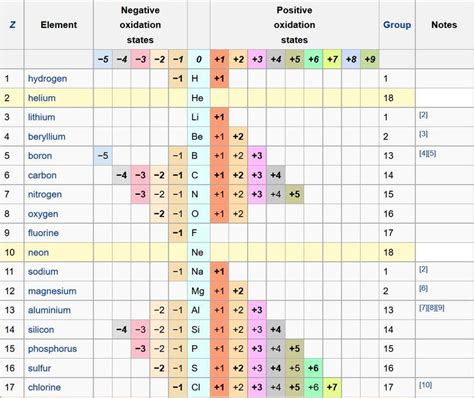
Металлы являются химическими элементами, обладающими высокой электропроводностью и восстановительными свойствами. Процесс восстановления в химии означает передачу электрона одного вещества другому, когда одно вещество окисляет, а другое восстанавливается. Восстановительные свойства металлов определяют их способность отдавать электроны в реакциях.
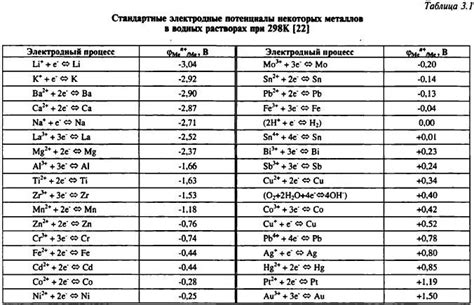
Порядок уменьшения восстановительных свойств металлов указывает, какой металл более легко отдаёт электрон и какой более трудно. В этом порядке металлы располагаются от самого активного до наименее активного. Существует несколько систем определения порядка уменьшения восстановительных свойств металлов, каждая из которых основана на определении стандартного потенциала восстановления металла.
- Система Латимера (абсолютная шкала), которая основана на стандартных потенциалах восстановления металлов по отношению к водороду;
- Система Кейгеля (относительная шкала), которая основана на сравнении металлов по их способности замещать друг друга в реакциях с соляной кислотой или солями.
Примерные порядки уменьшения для некоторых металлов по системе Латимера:
- Литий (Li)
- Калий (K)
- Барий (Ba)
- Кальций (Ca)
- Натрий (Na)
- Магний (Mg)
- Алюминий (Al)
Порядок уменьшения восстановительных свойств металлов играет важную роль во многих химических реакциях и процессах. Он определяет возможность металлов взаимодействовать с другими веществами и использоваться в различных отраслях промышленности, таких как производство электроники, строительство и многие другие.
Специфика восстановительных свойств металлов

Металлы обладают уникальными свойствами восстановления, которые выделяют их среди других материалов. Восстановительные свойства металлов позволяют им возвращаться в исходное состояние после подвергания различным воздействиям, таким как деформации, нагревание или обработка.
Одной из специфических черт восстановительных свойств металлов является их пластичность. Металлы могут подвергаться значительным деформациям без разрушения и при этом сохранять свою структуру. Это объясняется особенностями их кристаллической структуры и связями между атомами.
Кроме пластичности, металлы также обладают высокой устойчивостью к окислительным процессам. Они легко вступают в реакции с окислителями, но также активно возвращаются к своему исходному состоянию при воздействии редукторов. Эта способность к восстановлению позволяет использовать металлы в различных отраслях промышленности и технологии.
Важным аспектом восстановительных свойств металлов является их способность к самоочищению. Металлическая поверхность может восстанавливаться от окисления или загрязнения благодаря химическим реакциям на молекулярном уровне. Это позволяет сохранять эстетическую привлекательность и функциональность металлических изделий в течение длительного времени.
Все эти характеристики делают металлы незаменимыми материалами в различных отраслях промышленности, строительстве и производстве. Изучение и понимание специфики их восстановительных свойств является важной задачей для развития новых материалов и технологий.
Физико-химические особенности металлов с различными восстановительными свойствами
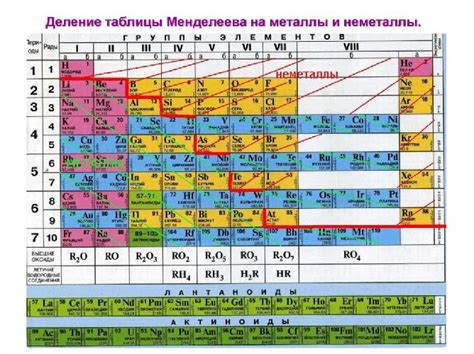
Металлы обладают различными физико-химическими свойствами, в том числе и восстановительными. Восстановительные свойства металлов зависят от их химической активности, электрохимического потенциала и способности образовывать соединения.
Наибольшие восстановительные свойства обычно проявляют металлы с высокими электрохимическими потенциалами, такие как щелочные металлы (например, литий, натрий, калий) и щелочноземельные металлы (например, магний, кальций). Эти металлы способны легко отдавать электроны и восстанавливать многие вещества, например, окислы или ионы металлов с более низкими электрохимическими потенциалами.
Однако, некоторые металлы обладают менее выраженными восстановительными свойствами. Например, платина и золото имеют низкий электрохимический потенциал и не проявляют ярко выраженных восстановительных свойств. Тем не менее, они все равно способны восстанавливать определенные вещества, но процесс более медленный и требует более сложных условий.
Восстановительные свойства металлов также могут быть изменены в зависимости от структуры материала. Например, легирование металлов различными элементами может повысить или понизить их восстановительные свойства. Также влияние на восстановительные свойства металлов оказывают факторы внешней среды, например, температура, давление и наличие кислорода.
Важность понимания порядка восстановительных свойств металлов при применении в различных отраслях промышленности

Восстановительные свойства металлов являются важным аспектом при их применении в различных отраслях промышленности. Понимание порядка уменьшения восстановительных свойств позволяет ученым и инженерам выбирать наиболее подходящий металл для определенного применения. Это крайне важно, так как каждый металл обладает уникальными свойствами и способностью устойчиво удерживать свою форму и структуру при длительном воздействии различных факторов.
В металлургии порядок уменьшения восстановительных свойств металлов имеет особое значение при выборе материала для производства товаров и конструкций. Например, при создании автомобилей важно выбирать металлы с высокими восстановительными свойствами, чтобы автомобиль был прочным и мог выдерживать нагрузки на проезжей части. Также при производстве легких конструкций и летательных аппаратов необходимы металлы с высокими восстановительными свойствами для обеспечения безопасности и долговечности.
Однако, для некоторых отраслей промышленности важно наоборот выбирать металлы с низкими восстановительными свойствами. Например, в электронике, где важны проводимость и электромагнитные свойства, используют металлы с низкой восстанавливающей способностью. Это позволяет металлам сохранять свои электрические и магнитные свойства без искажений и потерь при работе в различных условиях.
Кроме того, важно принимать во внимание факторы окружающей среды, в которых будет использоваться металл. Некоторые металлы могут быть подвержены коррозии или окислению при воздействии влаги или химических реактивов. Понимание порядка восстановительных свойств металлов позволяет выбрать наиболее устойчивый материал для отдельных условий, что приводит к повышению эффективности и улучшению качества продукции в различных отраслях промышленности.
Вопрос-ответ

Какие металлы имеют высокую восстановительную способность?
Некоторые металлы, имеющие высокую способность проявлять восстановительные свойства, включают алюминий, цинк и железо.
Какие факторы влияют на восстановительные свойства металлов?
Факторы, влияющие на восстановительные свойства металлов, включают их электрохимический потенциал, концентрацию окислителя и температуру реакции восстановления.
Какие металлы имеют низкую восстановительную способность?
Некоторые металлы, имеющие низкую способность проявлять восстановительные свойства, включают серебро, платину и золото.
Есть ли связь между восстановительными свойствами металлов и их валентностью?
Да, восстановительные свойства металлов обычно связаны с их валентностью. Металлы с более низкой валентностью имеют обычно высокую способность к восстановлению, в то время как металлы с более высокой валентностью имеют низкую способность к восстановлению.
Какие методы используются для определения восстановительных свойств металлов?
Для определения восстановительных свойств металлов можно использовать различные методы, включая электрохимические методы, спектроскопию и хроматографию.