Восстановительная активность металлов является одной из важных характеристик, определяющих их способность к окислительно-восстановительным реакциям. Она позволяет определить, с какой легкостью металл может отдавать электроны во время окисления, а также получать электроны при восстановлении. Важно отметить, что восстановительная активность металлов зависит от их химической природы, структуры и внешних условий.
Существует порядок убывания восстановительной активности металлов, который позволяет установить, какой металл является сильным окислителем, а какой – сильным восстановителем. Согласно этому порядку, сильными окислителями являются металлы, которые легко отдают электроны и приходят в состояние более высокой степени окисления. Например, такими металлами являются активные металлы, такие как литий (Li) и калий (K), а также металлы из группы платины, такие как палладий (Pd) и платина (Pt).
В то же время, сильными восстановителями являются металлы, которые с трудом отдают электроны и обладают большей способностью к восстановлению. К таким металлам относятся, например, золото (Au) и серебро (Ag). Они способны образовывать стабильные окисные формы и имеют отрицательные стандартные электродные потенциалы.
Порядок снижения активности восстановления металлов

Активность восстановления металлов – это способность металла при взаимодействии с окислителем образовывать ионы металла с более низкой степенью окисления. Порядок снижения активности восстановления металлов определяется их положением в ряду электродного потенциала (ряд Ноль).
Согласно ряду Ноль, металлы располагаются в порядке убывания активности восстановления – от самых активных к наименее активным. Так, наиболее активными металлами являются щелочные металлы (литий, натрий, калий и др.), которые имеют наибольшую способность к восстановлению.
На следующей ступени по активности находятся щелочноземельные металлы (магний, кальций, барий и др.). Они обладают более низкой активностью восстановления по сравнению со щелочными металлами, но все равно являются достаточно активными.
Далее в ряду следуют металлы д-блока – переходные металлы, которые обладают различной активностью восстановления. Например, цинк и железо восстанавливаются средней активностью, а медь, серебро и золото имеют низкую активность восстановления.
Наиболее неактивные металлы находятся на последней ступени в порядке снижения активности восстановления. К этой группе относятся платина, родий, иридий, золото и другие драгоценные металлы. Они обладают очень низкой активностью восстановления и мало реагируют с окислителями.
Активность восстановления элементов периода 1
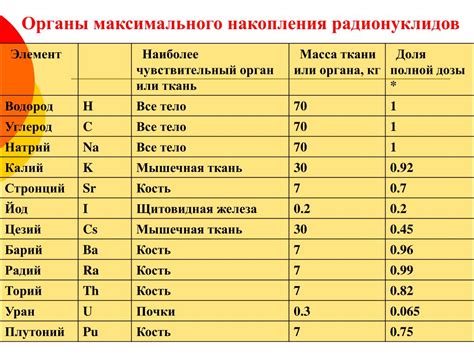
Периодическая система химических элементов включает в себя 7 периодов, каждый из которых включает различное количество элементов. В периоде 1 находятся два элемента: водород (H) и гелий (He).
Активность восстановления элементов периода 1 определяется их способностью получить электроны и образовать положительные ионы. При этом активность восстановления увеличивается по мере увеличения атомного радиуса элемента и, соответственно, уменьшения его протонного заряда.
Первым элементом периода 1 является водород (H), который имеет наибольшую активность восстановления среди всех элементов периодической системы. Водород обладает единственным электроном во внешней оболочке, что позволяет ему легко получать электроны от других элементов.
Вторым элементом периода 1 является гелий (He). Гелий является инертным газом и не образует ионов. Поэтому, его активность восстановления равна нулю. Гелий является самым стабильным элементом периода 1 и не образует простых ионов.
Активность восстановления элементов периода 2 и 3
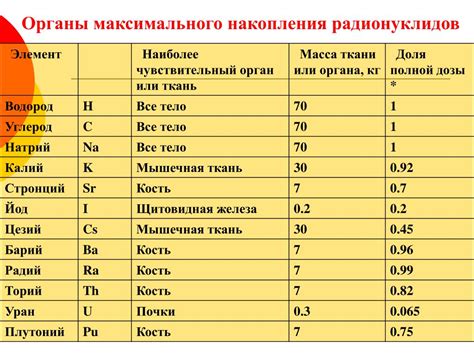
Восстановительная активность металлов представляет собой их способность переходить из окисленного состояния в восстановленное, при этом снижая окислительность других веществ. В периоде 2 и 3 периодической системы элементов наиболее активными восстановителями являются алюминий, магний и цинк.
Алюминий обладает высокой активностью восстановления благодаря своей электроотрицательности и относительно низкому потенциалу восстановления. Он способен вступать в реакции с кислородом, водой и многими кислотами, образуя оксиды или соли. Восстановительная активность алюминия позволяет использовать его в промышленности, например, при производстве алюминиевых сплавов и конструкций.
Магний также является сильным восстановителем, способным образовывать стабильные оксиды и соли. Он проявляет реактивность при взаимодействии с водой, выделяя водород. Магний встречается как часть многих минералов и имеет широкое применение в промышленности, например, в производстве сплавов и легких металлических конструкций.
Цинк также обладает высокой активностью восстановления. Он образует оксиды и соли, проявляет способность растворяться в кислотах и вступать в реакции с водой. Цинк используется в различных отраслях промышленности, в том числе в производстве оцинкованных материалов, аккумуляторах и покрытиях для защиты от коррозии.
Активность восстановления элементов периода 4, 5 и 6

Активность восстановления металлов зависит от их положения в периодической системе элементов. В периоде 4 находятся такие металлы, как железо, марганец, кобальт. Они обладают высокой активностью восстановления и способны легко переходить в ионы низшей степени окисления.
Металлы периода 5, такие как хром, молибден, вольфрам, обладают еще большей активностью восстановления. Они способны восстанавливать ионы более высокой степени окисления и эффективно участвовать в различных реакциях.
Металлы периода 6, включают титан, зирконий, гафний. Они обладают очень высокой активностью восстановления и способны восстанавливать ионы самой высокой степени окисления. Эти металлы широко применяются в различных отраслях промышленности и технологий, благодаря своей устойчивости и химической активности.
Восстановительные свойства металлов имеют важное значение для многих процессов, таких как гальваническое покрытие, электролиз, электрохимические реакции и другие. Изучение активности восстановления металлов позволяет определить их потенциал использования в различных технологиях и применениях.
Вопрос-ответ

Какие металлы восстанавливаются быстрее всего?
Металлы, которые имеют большую активность, обычно восстанавливаются быстрее всего. К таким металлам относятся, например, калий, натрий и цинк.
Какой металл имеет самую низкую активность и поэтому восстанавливается медленнее других?
Металлы с низкой активностью, такие как серебро или медь, могут восстанавливаться медленнее, чем металлы с более высокими уровнями активности. Это связано с электрохимическими свойствами металлов.
