Щелочные металлы - это группа элементов периодической системы, расположенная на первой группе. В эту группу входят литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы обладают рядом уникальных свойств, которые делают их популярными в различных областях науки и технологий.
Первым и наиболее заметным свойством щелочных металлов является их высокая реактивность. Они легко и быстро реагируют с водой, кислородом и другими веществами, образуя щелочные растворы или оксиды. Это свойство обусловлено тем, что у щелочных металлов всего один электрон в внешней энергетической оболочке, что делает их непостоянными и стремящимися к реакциям.
Вторым важным свойством щелочных металлов является их низкая плотность. Литий, например, является самым легким из всех металлов, а калий и цезий также обладают низкими плотностями. Это делает их полезными в различных технических приложениях, таких как производство легких сплавов и создание легких материалов.
Щелочные металлы также известны своей способностью генерировать сильные основания и обладать высокой электропроводностью. В результате всего этого, они широко используются в химической промышленности, для производства щелочей и аккумуляторов, а также в процессах синтеза и электролиза.
Кроме того, щелочные металлы обладают яркой пламенной реакцией при сжигании, что делает их полезными в фейерверке и пиротехнике. Некоторые щелочные металлы также обладают способностью светиться при взаимодействии с водой или кислородом, что делает их привлекательными для использования в фосфоресцентных материалах и светящихся красках.
В целом, щелочные металлы являются фундаментальными элементами с уникальными свойствами и широким спектром применения. Изучение их природы и активности имеет большое значение как для фундаментальной науки, так и для развития многочисленных областей технологий и промышленности.
Что такое щелочные металлы и их роль в природе

Щелочные металлы – это группа химических элементов, включающая литий, натрий, калий, рубидий, цезий и франций. Они относятся к первой группе периодической системы. Щелочные металлы получили такое название из-за своей реактивности и способности образовывать щелочные растворы, которые обладают выраженными щелочными свойствами.
Щелочные металлы имеют важную роль в природе. Во-первых, они широко распространены как составные части минералов и руд. Например, натрий входит в состав поваренной и пищевой соли, а калий является необходимым элементом растений и находится в почвах. Кроме того, ионы щелочных металлов активно участвуют в метаболических процессах живых организмов.
Щелочные металлы также проявляют высокую активность и реактивность. Они с легкостью окисляются воздухом, образуя оксиды, и обладают сильной аффинностью к воде, реагируя с ней с выделением водорода и образованием щелочи. Эти свойства щелочных металлов приводят к множеству практических применений в различных отраслях, включая химическую, фармацевтическую и металлургическую промышленности.
В заключение, щелочные металлы представляют собой важную группу элементов, играющую существенную роль в природе. Их свойства и активность определяют их многочисленные применения в различных сферах жизни человека. Понимание химических свойств и реакционной способности щелочных металлов позволяет использовать их в разработке новых материалов и технологий, способствуя прогрессу и развитию общества.
Активность и особенности группы щелочных металлов

Группа щелочных металлов включает в себя элементы первой группы периодической системы: литий, натрий, калий, рубидий, цезий и франций. Щелочные металлы характеризуются высокой активностью, что связано с их электрохимическим потенциалом. Они обладают низкими значениями первой ионизационной энергии, что обусловлено легкостью отщепления внешней электронной оболочки.
Одной из особенностей группы щелочных металлов является их низкая плотность, что делает их легкими и подвижными. Они также обладают низкой температурой плавления и кипения. Кроме того, щелочные металлы хорошо проводят тепло и электричество, что делает их важными материалами для применения в различных областях, включая электронику и энергетику.
Еще одной особенностью группы щелочных металлов является их реакционная способность. Они реагируют с водой, часто с разрушительными последствиями, образуя гидроксиды и выделяя водород. Эта реакция с водой столь сильна, что натрий и калий даже могут вызывать возгорание. Они также реагируют с кислородом, образуя оксиды.
Щелочные металлы играют важную роль в биологии, так как являются необходимыми для многих физиологических процессов в организмах живых существ. Они также широко используются в промышленности, включая производство стекла, щелочных батарей и многих других продуктов.
Основные свойства щелочных металлов и их важность

Щелочные металлы - это группа элементов периодической таблицы, которая включает литий, натрий, калий, рубидий, цезий и франций. Они получили своё название благодаря высокой щелочности своих соединений. Эти металлы имеют ряд основных свойств, которые придают им важность в различных сферах нашей жизни.
Первое основное свойство - низкая плотность. Щелочные металлы являются легкими элементами, что делает их удобными для использования в различных технических приложениях, например, для создания лёгких конструкций и материалов.
Второе основное свойство - высокая реактивность. Щелочные металлы легко реагируют с водой, кислородом и другими элементами, что делает их полезными в химической промышленности и процессах синтеза различных веществ.
Третье основное свойство - способность образовывать ионы с положительным зарядом. Ионы щелочных металлов использованы в множестве технологий и приложений, включая электролиты в аккумуляторах и солнечных батареях, а также в качестве катализаторов в химических реакциях.
Четвёртое основное свойство - низкая электроотрицательность. Это означает, что щелочные металлы отдают электроны с легкостью, что делает их полезными в различных электротехнических приложениях, например, для создания проводящих материалов и элементов электрических цепей.
Важность щелочных металлов в нашей жизни трудно переоценить. Они находят применение в различных областях, от промышленности до медицины. Эти металлы играют важную роль в современных технологиях и являются неотъемлемой частью нашей повседневной жизни.
Физические и химические свойства щелочных металлов
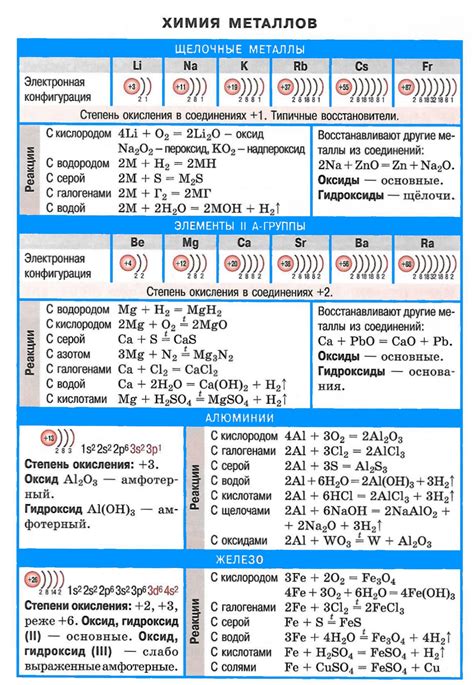
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают рядом уникальных физических и химических свойств. Эти металлы являются очень активными химическими элементами и реагируют с водой, кислородом и многими другими веществами.
Одним из важных физических свойств щелочных металлов является их низкая плотность. Например, литий имеет плотность всего 0,53 г/см³, что делает его одним из наименьших по плотности металлов. Натрий имеет плотность 0,97 г/см³, а калий - 0,86 г/см³. Это значит, что эти металлы оказываются легкими и могут даже плавать в некоторых жидкостях.
Химические свойства щелочных металлов базируются на их высокой активности. Они сильно реагируют с водой, образуя сильные щелочные растворы гидроксидов. Например, реакция натрия с водой протекает с выделением водорода и образованием гидроксида натрия:
2Na + 2H2O → 2NaOH + H2
Щелочные металлы могут реагировать не только с водой, но и с кислородом воздуха. При этом образуются оксиды металлов. Например, реакция калия с кислородом протекает следующим образом:
4K + O2 → 2K2O
Важно отметить также высокую электропроводность щелочных металлов. Она обусловлена наличием свободных электронов в их кристаллической решетке. Электроды из щелочных металлов широко используются в электрохимических процессах, таких как электролиз и гальваническая коррозия.
Распространение и использование щелочных металлов

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, широко распространены в природе. Они встречаются в различных минералах, включая соли, глины и руды.
Литий, например, можно найти в рудах сподумена и лепидолита, которые добываются в различных странах, включая Австралию, Чили и Китай. Натрий, более известный как поваренная соль, широко присутствует в морской воде и соляных рудах. Калий находится в глубоких залежах соляных отложений и древних озерах.
Щелочные металлы имеют широкое применение в различных отраслях промышленности и науки. Натрий, например, используется в производстве стекла, мыла, отбеливателей и химических реактивов. Калий является необходимым элементом для растений, и его соли используются в сельском хозяйстве как удобрения. Литий, благодаря своим уникальным физическим и химическим свойствам, находит применение в производстве литиевых батарей, лекарств и специальных сплавов.
В научных исследованиях щелочные металлы активно используются в качестве катализаторов, реагентов и основных компонентов различных экспериментальных систем. Они играют важную роль в химической и физической науке, а также в разработке новых технологий и материалов.
Щелочные металлы в природе и их промышленное применение

Щелочные металлы – это группа элементов, состоящих из лития (Li), натрия (Na), калия (K), рубидия (Rb), цезия (Cs) и франция (Fr). Они получили свое название из-за своей химической активности и склонности образовывать щелочные растворы. Щелочные металлы широко распространены в природе и обладают рядом уникальных свойств, которые делают их важными для промышленности и научных исследований.
В природе щелочные металлы встречаются в виде солей, таких как хлориды, сульфаты и карбонаты, а также в рудах и минералах. Например, натрий находится в морской воде и в земле, а калий обильно присутствует в поташе и сильноминерализированных озерах. По своей природе щелочные металлы реактивны и легко реагируют с водой, воздухом и другими веществами.
Щелочные металлы имеют широкое промышленное применение. Например, натрий используется в производстве стекла, мыла, щелочных батарей и удобрений. Калий используется для производства удобрений, стекла и моющих средств. Литий используется в батареях, лекарственных препаратах и керамике. Рубидий и цезий нашли применение в научных исследованиях, металлах и электронике.
Щелочные металлы обладают высокой электропроводностью, низкой плотностью и низкой температурой плавления. Они также являются ключевыми компонентами при производстве многих химических соединений, включая лекарственные препараты и пластик. Благодаря своим уникальным свойствам, щелочные металлы играют важную роль в различных отраслях промышленности и научных исследованиях.
Вопрос-ответ

Каково происхождение щелочных металлов?
Щелочные металлы (литий, натрий, калий, рубидий, цезий, франций) являются самыми легкими металлами и играют важную роль в химической промышленности и науке. Они образуют семейство элементов, которые находятся в первой группе периодической системы химических элементов.
В чем заключаются особенности и свойства щелочных металлов?
Особенности и свойства щелочных металлов включают их высокую активность, низкую плотность, низкую температуру плавления и кипения, низкую твердость, мягкость, отличную теплопроводность и электропроводность. Они также обладают способностью образовывать стабильные оксиды и гидроксиды.
Каковы основные свойства щелочных металлов?
Основные свойства щелочных металлов включают высокую активность, низкую плотность, низкую температуру плавления и кипения, низкую твердость, мягкость, отличную теплопроводность и электропроводность. Они также обладают способностью образовывать стабильные оксиды и гидроксиды.
Какова активность щелочных металлов?
Щелочные металлы являются самыми активными металлами в периодической системе. Они легко реагируют с водой и кислородом, образуя гидроксиды и оксиды соответственно. Также они могут реагировать с другими элементами и соединениями, образуя различные соли и соединения.
Какая роль щелочных металлов в химической промышленности и науке?
Щелочные металлы играют важную роль в химической промышленности и науке. Они используются для производства сплавов, алюминия, стекла, мыла, лекарств, удобрений и многих других продуктов. Они также широко используются в лабораториях для проведения различных экспериментов и исследований.
