Щелочные металлы - это группа химических элементов, включающая литий, натрий, калий, рубидий и цезий. Эти металлы имеют низкую плотность, низкую температуру плавления и высокую реакционную способность. Получение щелочных металлов стало важным процессом в химической промышленности, так как они находят широкое применение в различных отраслях, включая производство батареек, легирование сталей и производство стекла.
Основным методом получения щелочных металлов является электролиз. Этот процесс основан на использовании электрического тока для разложения соединений щелочных металлов на ионы и их последующей редукции на электроде. В ходе электролиза, катод, на который осаждаются ионы металла, соприкасается с электролитом, в котором находятся металлические ионы. Анод же служит источником электронов, необходимых для редокции ионов металла.
Процесс электролиза варьируется в зависимости от конкретного щелочного металла, который получается. Например, для получения лития используются тигли с графитовым электродом, а электролитом может служить расплавленный хлорид лития. Натрий же получают электролизом расплавленного хлорида натрия, используя стальные электроды. Калий, рубидий и цезий получают электролизом расплавленных хлоридов или гидроксидов соответствующих металлов.
Электролиз является эффективным источником щелочных металлов, так как он позволяет получить их с высокой степенью чистоты и довольно высокой эффективностью. Однако, процесс электролиза требует использования значительного количества энергии и специализированного оборудования. Поэтому, исследования в области более эффективных и экологически чистых методов получения щелочных металлов продолжают проводиться.
Получение щелочных металлов электролизом

Щелочные металлы, такие как литий, натрий и калий, являются важными элементами для многих областей промышленности и научных исследований. Их получают путем электролиза соответствующих солей или галогенидов.
Процесс получения щелочных металлов электролизом основан на использовании электрического тока для разложения ионов металла в растворе. Для этого используют специальные электролиты, содержащие соответствующие катионы.
При электролизе, анодом служит материал с высоким окислительным потенциалом, обычно графит или платина, куда поступают электроны, образуя анионы. Эти анионы движутся к катоду, где происходит их восстановление в виде металла.
Одним из преимуществ электролиза является возможность получения чистых металлов с высокой степенью очистки. Это важно, так как примеси могут существенно влиять на свойства и качество получаемого продукта.
В процессе электролиза щелочных металлов также образуются газы (кислород на аноде и водород на катоде), которые нужно отводить. Для этого используют специальные электролитические ячейки с разделительными мембранами или электролизеры, где газы собираются, а продукт – чистый металл – извлекается из раствора.
Основные принципы и процессы
Электролиз является одним из основных способов получения щелочных металлов, таких как натрий и калий. Этот процесс основан на использовании электрического тока для разложения соединений металла в ионы в растворе или плавленом состоянии.
Для проведения электролиза требуется электролит, который состоит из соли или оксида металла в расплавленном состоянии или в растворе. Отрицательный электрод, или катод, с присоединенными к нему отрицательными зарядами, привлекает положительные ионы металла и приводит к их осаждению или выделению металлических отложений.
Положительный электрод, или анод, привлекает отрицательные анионы, которые образуются в процессе разложения соли или оксида металла. Эти анионы обычно реагируют с водой или с другим раствором, образуя газы или оксиды.
Процесс электролиза требует энергии, обычно поставляемой из внешнего источника, такого как электродвигатель. Ток, протекающий через электролит, должен иметь достаточную силу и правильное направление, чтобы проходить через раствор или плавленное состояние металла и вызывать разложение вещества.
История развития электролиза щелочных металлов

Электролиз щелочных металлов - это процесс получения металлов, таких как натрий и калий, путем проведения электролиза ионов в водных растворах щелочных галогенидов. Этот метод получения металлов имеет долгую историю развития, начиная с первых экспериментов в XIX веке.
Первые попытки получить металлы электролизом состояли в применении гальванических ячеек. Именно в такой батарее Б. Франклин проводил свои опыты в 18 веке и впервые назвал явление электролиза. Однако в те времена не была найдена общая закономерность процесса и не известно было, какими веществами можно проводить электролиз.
В средине XIX века ученые добились прорыва в изучении электролиза. Фредерик Свентон открыл, что натрий может быть выделен электролизом плавительных щелочных галогенидов. Этот эксперимент стал отправной точкой для дальнейшего развития метода получения щелочных металлов.
В последующие годы были проведены множество исследований и улучшений в процессе электролиза щелочных металлов. Ученые изучали влияние температуры, концентрации электролита, силы тока и других факторов на выход и качество получаемых металлов. Были разработаны новые формулы и методы, позволяющие повысить эффективность процесса и уменьшить затраты энергии.
Сегодня электролиз щелочных металлов является одним из основных источников получения натрия и калия. Он широко применяется в различных областях, включая производство легких металлов, химическую промышленность, энергетику и др. Благодаря постоянному развитию методов и технологий, электролиз щелочных металлов становится все более эффективным и экологически безопасным способом получения ценных металлов.
Преимущества электролиза перед другими способами получения щелочных металлов

Электролиз является одним из основных способов получения щелочных металлов, таких как натрий и калий. Он имеет ряд преимуществ по сравнению с другими методами производства:
- Экономическая эффективность. Электролиз позволяет производить щелочные металлы в больших объемах и достаточно быстро. Это делает процесс более выгодным в плане затрат на производство и оборудования.
- Высокая чистота получаемого продукта. Электролиз позволяет получать металлы с очень высокой степенью чистоты. Это особенно важно для использования щелочных металлов в различных отраслях, таких как фармацевтика или электроника, где требуется чистота продукта.
- Возможность контроля процесса. Электролиз позволяет достаточно точно контролировать химические реакции, происходящие во время процесса получения металлов. Это позволяет регулировать параметры, такие как температура и концентрация раствора, и тем самым повышать эффективность процесса и получать более качественный продукт.
- Экологическая безопасность. Электролиз не требует использования опасных или вредных химических реагентов. В процессе получения металлов электролизом практически не выделяется вредных веществ, что важно с точки зрения охраны окружающей среды и безопасности персонала.
В целом, электролиз является эффективным и безопасным методом получения щелочных металлов, обладающим рядом преимуществ по сравнению с другими способами производства.
Особенности электролиза различных щелочных металлов

Электролиз является одним из самых эффективных способов получения щелочных металлов, таких как натрий, калий и литий. Каждый из этих металлов имеет свои особенности и требует определенных условий для успешного электролиза.
Натрий. Для электролиза натрия требуется высокая температура, обычно около 600 °С, чтобы обеспечить достаточную подвижность ионов. Также нужен электролит, способный растворять натрий, например, расплавленный хлористый натрий или галит.
Калий. Электролиз калия также требует высокой температуры, около 700 °С. Калий выбирают в качестве электролита обычно смесь расплавленных хлористого калия и бромида калия. Этот процесс также требует применения многочисленных запасных анодов, так как калий очень реактивный и может вызвать коррозию применяемых материалов.
Литий. В отличие от натрия и калия, электролиз лития проводят при намного более низкой температуре, около 250 °С. Литий требует использования органических растворителей, таких как ацитонитрил, чтобы получить эффективную проводимость. Кроме того, в процессе электролиза лития возникает проблема окисления самого металла, поэтому требуется строгий контроль условий.
Из-за этих особенностей электролиза, получение различных щелочных металлов требует применения специальных режимов работы и материалов. Правильный подбор параметров и контроль процесса позволяют эффективно и безопасно получить необходимый металл с высокой степенью чистоты.
Технологические аспекты процесса электролиза щелочных металлов
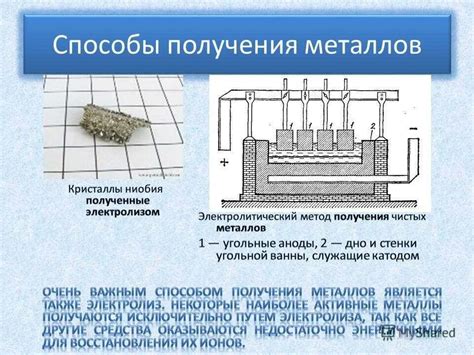
Электролиз щелочных металлов, таких как натрий и калий, является важным процессом в промышленности. Технология электролиза позволяет получать эти металлы в больших объемах и с высоким уровнем чистоты.
Основным принципом процесса электролиза щелочных металлов является разрушение ионной связи в соли металла путем пропускания электрического тока через электролит. Для проведения электролиза применяется специальный электролизер, состоящий из анода и катода, разделенных проигрывателем.
В процессе электролиза на аноде происходит окисление ионов металла, а на катоде - восстановление этих ионов. При этом, щелочные металлы образуются на катоде в виде металлического осадка, который затем отделяется и собирается.
Для эффективного процесса электролиза щелочных металлов важно поддерживать определенные условия. Например, необходимо поддерживать определенную температуру и концентрацию электролита, контролировать ток и напряжение, обеспечивать устойчивую работу электролизера.
Электролиз щелочных металлов является энергоемким процессом, поэтому в промышленности широкое применение находят высокотемпературные электролизеры, которые позволяют снизить энергозатраты. Также, для увеличения эффективности процесса, используются специальные добавки и катализаторы.
Современные тенденции в развитии электролиза для получения щелочных металлов
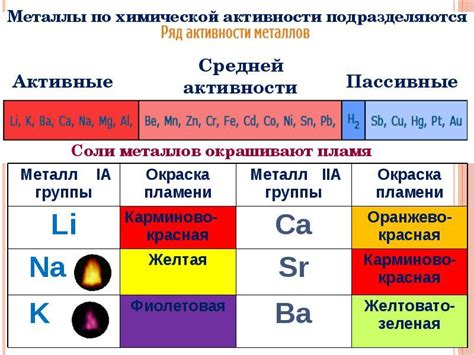
Электролиз является одним из основных методов для получения щелочных металлов, таких как натрий и калий. В последние годы развитие электролиза направлено на улучшение эффективности и энергоэкономичности процесса.
Одной из современных тенденций является использование новых электролитических растворов, которые позволяют снизить температуру электролиза и увеличить получаемую выход продукта. Также исследуются новые материалы для анодов и катодов, которые обладают более высокой стабильностью и эффективностью.
Другой актуальной тенденцией является разработка новых систем управления и контроля процесса электролиза. Внедрение автоматических систем позволяет следить за процессом на всех его этапах и корректировать параметры для достижения наилучших результатов. Также важным аспектом является мониторинг и контроль энергопотребления для оптимизации процесса.
Одним из вызовов современного электролиза является увеличение удельного выхода продукта и снижение энергозатрат. Для достижения этих целей проводятся исследования в области новых электродных материалов и конструктивных решений, которые могут повысить эффективность процесса.
Кроме того, современные технологии электролиза также подразумевают более энергоэкономичную систему утилизации отходов и переработки побочных продуктов. Это позволяет сократить негативное воздействие на окружающую среду и повысить устойчивость процесса.
В целом, современные тенденции в электролизе для получения щелочных металлов направлены на повышение эффективности, энергоэкономичности и экологической устойчивости процесса. Исследования в области новых материалов, управления процессом и переработки продуктов позволяют преодолевать существующие ограничения и совершенствовать этот метод производства щелочных металлов.
Вопрос-ответ

Какие щелочные металлы можно получить электролизом?
Щелочные металлы, такие как натрий и калий, могут быть получены электролизом. Они находятся в первой группе периодической таблицы и имеют низкую стандартную электродную потенцию, что делает их хорошими кандидатами для электролиза.
Каковы основные принципы процесса получения щелочных металлов электролизом?
Основное принципиальное состоит в использовании электролиза для разложения расплава, содержащего ионы соответствующих металлов. При подаче тока через электролит, катионы щелочных металлов перемещаются к катоду, где получают электроны и осаждается соответствующий металл.
