Электролиз водных растворов является важным процессом в современной химии и металлургии. Он позволяет получать различные металлы из их соединений, осуществляя электрохимическую реакцию водорода или кислорода с веществами, растворенными в воде. Этот метод отличается высокой степенью эффективности и удобством, что позволяет использовать его в различных областях, включая производство металлов и проведение экспериментов в лабораторных условиях.
Процесс электролиза основан на применении постоянного электрического тока, который приводит к разложению растворенных веществ на ионы и их последующему осаждению на электродах. В зависимости от типа раствора и выбранного катода и анода, можно получать различные металлы. Например, при электролизе водного раствора серной кислоты с использованием платиновых электродов, на катоде осаждается водород, а с анода выделяется кислород. А при электролизе растворов медных солей можно получить медь на катоде.
Важно отметить, что для успешного процесса электролиза необходимо правильно подобрать раствор, электроды и параметры работы электрического тока.
Электролиз водных растворов является основой для множества промышленных процессов, таких как производство алюминия, цинка, никеля, хлора и других металлов и веществ. Благодаря электролизу, мы можем получать различные металлы для использования в промышленности, строительстве и производстве электроники. Этот метод также позволяет проводить эксперименты и исследования в области химии и физики, изучая процессы производства металлов и их свойства.
Принципы электролиза водных растворов
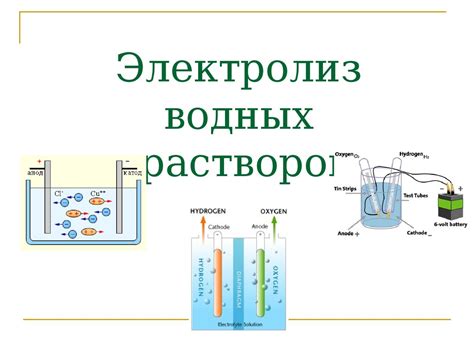
Электролиз водных растворов основан на передаче электрического тока через раствор с целью производства металлов на электродах. В процессе электролиза в водном растворе присутствуют ионы металлов и величина тока направляет процесс осаждения металла на электроде.
Основной принцип электролиза водных растворов заключается в разделении зарядов при подведении электрического тока к раствору. На аноде происходит окисление отрицательно заряженных ионов, а на катоде происходит восстановление положительно заряженных ионов.
Вода в процессе электролиза разлагается на положительно заряженные ионы водорода (H+) и отрицательно заряженные ионы гидроксила (OH-). Гидроксильные ионы необходимы для электролитического осаждения металлов, так как они могут соединяться с положительно заряженными ионами металла и образовывать осадок на катоде.
Во время электролиза важную роль играют также концентрация и физическое состояние веществ в растворе, температура и интенсивность тока. Оптимальные условия электролиза определяются свойствами конкретного металла и характером раствора, в котором он находится.
Применение электролиза водных растворов широко используется в промышленности для получения различных металлов, таких как медь, никель, цинк и т.д. Этот метод является эффективным и экономически выгодным способом получения металлов высокой чистоты.
Физические основы процесса электролиза
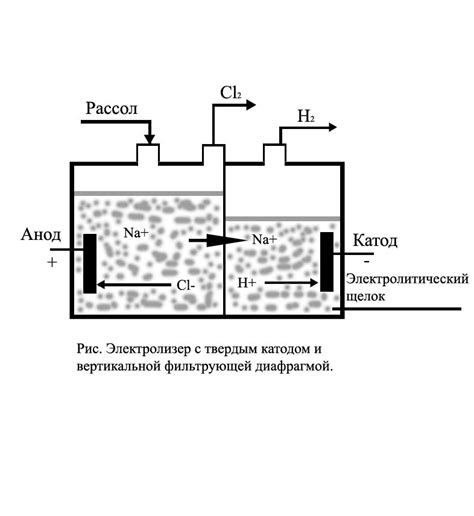
Электролиз – это процесс разложения веществ под действием электрического тока. В основе электролиза лежат электрические и химические явления. При электролизе водных растворов металлов происходит электрохимический процесс, который позволяет получить металлы в чистом виде.
Основной принцип электролиза основан на двух электродах – катоде и аноде. Катод положительно заряжен, а анод – отрицательно. В электролитическую ячейку погружают металлические пластины – электроды, которые служат для передачи электрического тока в раствор. Разложение раствора происходит под влиянием постоянного электрического тока.
В процессе электролиза в водных растворах металлов происходит процесс направленного движения ионов через раствор. Положительно заряженные ионы мигрируют к аноду, а отрицательно заряженные – к катоду. Когда ионы достигают электрода, они теряют свою зарядку и становятся нейтральными атомами. В результате этого процесса на электродах образуется слой металлического осадка.
Одним из ключевых факторов в процессе электролиза является концентрация раствора. Чем выше концентрация раствора, тем больше ионов содержится в нем. Благодаря этому, электролиз можно провести более эффективно и быстро получить большое количество металла. Кроме того, важным фактором является плотность тока – чем выше плотность тока, тем интенсивнее протекает процесс электролиза и тем быстрее можно получить металлический осадок.
Механизм образования металлов при электролизе

Образование металлов при электролизе водных растворов основано на процессе электролиза, который осуществляется с использованием электрического тока. В ходе данного процесса происходят электрохимические реакции, в результате которых ионные формы металлов превращаются в нейтральные атомы, образующие металлическое отложение на электроде.
При электролизе водных растворов металлов используются два электрода – анод и катод. На аноде происходит окислительная реакция, при которой ионы металла отдают электроны. Таким образом, положительно заряженные ионы металла превращаются в нейтральные атомы, которые могут образовывать отложения на поверхности анода.
В то же время, на катоде происходит восстановительная реакция, при которой протоны (водородные ионы) принимают электроны. В некоторых случаях, на катоде также может образовываться металлическое отложение, если металл, который нужно получить, имеет большую степень восстановления по сравнению с водородом.
Эффективность образования металлов при электролизе водных растворов зависит от ряда факторов, таких как концентрация металлов в растворе, сила тока, время электролиза, состояние поверхности электродов и другие. Правильный выбор условий электролиза позволяет достичь высокой степени очистки металлов и получить качественное металлическое отложение на электродах.
Влияние плотности тока на процесс электролиза

Электролиз – это процесс, при котором происходит разложение растворенного ионного вещества под воздействием электрического тока. Одним из факторов, влияющих на процесс электролиза, является плотность тока.
Плотность тока определяет количество электрического заряда, протекающего через раствор за единицу времени и площадь поперечного сечения раствора. Чем выше плотность тока, тем больше электрического заряда протекает через раствор, и, следовательно, ускоряется процесс электролиза.
При повышении плотности тока увеличивается скорость электродных реакций и ускоряется процесс осаждения металлов из раствора. Это связано с увеличением количества свободных электронов, участвующих в реакциях на электродах. При этом можно наблюдать увеличение скорости осаждения металла на катоде и растворения металла на аноде.
Однако необходимо учитывать, что при слишком высокой плотности тока может возникнуть ряд проблем. Например, увеличение плотности тока может привести к увеличению тепловыделения и перегреву электролита. Также, возможно образование пузырьков газа на поверхности электрода, что может затруднить процесс электролиза и снизить эффективность получения металлов.
Таким образом, плотность тока является важным параметром при электролизе водных растворов, она определяет скорость разложения растворенного вещества и эффективность процесса получения металлов. Оптимальное значение плотности тока должно быть выбрано с учетом конкретных условий и требований процесса электролиза.
Промышленное применение электролиза водных растворов

Электролиз водных растворов находит широкое промышленное применение в различных отраслях. Одной из основных сфер, где используется электролиз, является получение металлов. Этот процесс позволяет получить высококачественные металлические продукты, использующиеся в различных областях промышленности.
Одним из наиболее распространенных способов получения металлов при электролизе водных растворов является метод гальваники. При этом процессе металл, который требуется получить, выпадает на электрод из водного раствора под действием электрического тока. При этом использование различных электродов позволяет получать разные металлы.
Преимущества промышленного применения электролиза водных растворов включают высокую эффективность и экономичность процесса. Этот метод позволяет получать металлы с высокой степенью чистоты и качества, что является необходимым требованием во многих отраслях промышленности.
Кроме того, промышленное применение электролиза водных растворов распространено в процессе очистки отходов и переработки вторичных ресурсов. Электролиз позволяет извлекать ценные металлы из использованных и отработанных объектов, что способствует экономии природных ресурсов и позволяет снизить негативное воздействие на окружающую среду.
Вопрос-ответ

Какой процесс происходит при электролизе водных растворов?
При электролизе водных растворов происходит разложение воды на водород и кислород с помощью электрического тока.
Какие металлы можно получить при электролизе водных растворов?
При электролизе водных растворов можно получить различные металлы, в зависимости от раствора и условий процесса. Например, из раствора соли меди можно получить медь, а из раствора соли железа можно получить железо.
