Электролиз - это процесс, в котором разложение вещества происходит под действием электрического тока. Основные принципы электролиза включают в себя электроды, электролит и ток. При этом положительный электрод, называемый анодом, является местом окисления и выделения отрицательно заряженных ионов, а отрицательный электрод, называемый катодом, служит местом редукции и осаждения положительно заряженных ионов.
В получении металлов электролиз широко используется в различных отраслях промышленности. Например, при производстве алюминия осуществляется электролиз трехслойной электролитической системы, состоящей из алюминия, оксида алюминия и хлорида алюминия. Алюминий выделяется на катоде, а кислород и хлор выделяются на аноде. Другой пример - получение никеля, где в качестве электролита используются растворы никельсодержащих солей, а на катоде осаждается никель, а на аноде выделяется кислород.
На ЕГЭ вопросы по электролизу возникают в разделе "Химия". Необходимо знать основные принципы электролиза, а также уметь применять их на практике. Например, в заданиях можно попросить определить массу ионов, осажденных на катоде, и количество электричества, прошедшего через раствор. Также может быть необходимо построить график зависимости массы осажденного вещества от времени.
Важно помнить, что электролиз - это энергозатратный процесс, поэтому его применение в промышленном масштабе требует значительных электрических затрат. Однако, электролиз остается одним из важных методов получения металлов, благодаря которому осуществляется их производство массового спроса.
Технология электролиза в металлургии
Электролиз — это процесс, при котором с помощью электрического тока происходит разложение веществ в растворе на положительно и отрицательно заряженные ионы. Технология электролиза широко применяется в металлургии для получения различных металлов.
Основной принцип электролиза заключается в использовании электролитических ячеек, состоящих из анода и катода, между которыми находится электролит. Под воздействием электрического тока происходит окисление анода и восстановление катода, что позволяет выделить металл в чистом виде из раствора.
При проведении электролиза металлы получают в виде катионов или анионов, в зависимости от типа электролита. Так, например, для получения алюминия используется электролиз расплава галогенидов алюминия, а для получения меди применяется электролиз сульфата меди.
Важной характеристикой процесса электролиза является электродный потенциал, определяющий направление протекания реакций на аноде и катоде. Величина потенциала зависит от реакционных условий и типа электролита. Она определяет эффективность процесса и требуемую энергию для проведения электролиза.
Технология электролиза играет важную роль в металлургической промышленности, позволяя получать металлы с высокой степенью чистоты. Она также позволяет контролировать процесс получения металлов, изменяя ампераж и время электролиза. В последние годы разработаны новые методы электролиза, что позволяет более эффективно использовать эту технологию и улучшать качество получаемых металлических продуктов.
Принцип работы электролизной ячейки
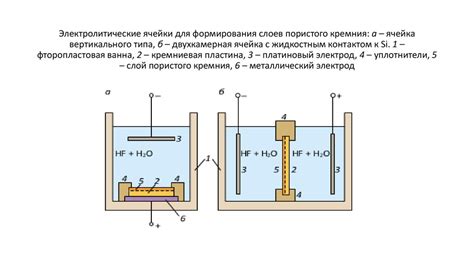
Электролизная ячейка представляет собой устройство, в котором проходит электролиз – процесс разложения вещества с помощью электрического тока. Принцип работы такой ячейки основан на использовании электролита, который является проводником электрического тока и одновременно раствором ионов вещества, подвергаемого электролизу.
Электролизная ячейка состоит из двух электродов – анода и катода, которые погружены в электролит. Анод – это положительно заряженный электрод, на котором происходит окисление вещества, а катод – отрицательно заряженный электрод, на котором происходит восстановление вещества.
При пропускании электрического тока через электролизную ячейку происходит разделение электролита на ионы вещества. Ионы положительного заряда (катионы) перемещаются к катоду, где получают электроны и превращаются в нейтральное вещество. Ионы отрицательного заряда (анионы), наоборот, перемещаются к аноду, где отдают электроны и превращаются в нейтральное вещество.
Таким образом, процесс электролиза позволяет получать металлы путем электрохимической реакции: на катоде происходит восстановление ионов металла в металлическую форму, а на аноде – окисление вещества, ответственного за поступление электронов на катод.
Применение электролиза в получении металлов находит широкое применение в промышленности. Это позволяет получать металлы высокой чистоты и крупнокристаллическую структуру, а также осуществлять переработку различных отходов.
Применение электролиза на ЕГЭ
На ЕГЭ в задачах по химии и физике часто встречаются задания, связанные с электролизом и его применением для получения металлов. Одним из таких примеров может быть задача на определение массы металла, выделенного при электролизе раствора соли.
В задачах с электролизом на ЕГЭ важно уметь определить степень окисления металла и ион, который будет образовываться при разложении раствора. Также требуется знать, какой тип электродов использовать и какие реакции происходят на электродах.
Обычно в задачах на ЕГЭ приводятся данные о токе, времени, а также электроды, между которыми проводится электролиз. Необходимо уметь правильно применять законы электролиза, чтобы определить массу металла, выделенного при данном условии.
Электролиз является важным инструментом в современной промышленности. Не только получение металлов, но и процессы покрытия металлов, электрохимические реакции и другие процессы связаны с использованием электролиза. Поэтому знание этой темы на ЭКЗ может пригодиться в реальной жизни.
Задания ЕГЭ по электролизу и их решение
На ЕГЭ по химии могут появиться задания, связанные с электролизом и получением металлов. Для успешного решения таких задач необходимо хорошо знать основные принципы электролиза и уметь применять их на практике.
Одно из типичных заданий по электролизу - определение продолжительности электролиза. Для решения этого задания необходимо знать формулу, связывающую количество электричества, время и силу тока. Также важно учесть коэффициенты электрохимических реакций и степень окисления и восстановления веществ.
Еще одно задание по электролизу может предлагать рассчитать количество вещества, полученного в результате электролиза. Для решения этой задачи нужно знать соотношение между количеством электричества, затраченным на электролиз, и количеством вещества, полученного в результате реакции. Также важно учесть массу электрода и плотность тока.
Задания по электролизу могут также требовать определения окислительной или восстановительной активности вещества. При решении такой задачи важно анализировать потенциалы полуэлементов и использовать таблицу стандартных потенциалов электродных реакций.
В заключение, для успешного решения заданий по электролизу на ЕГЭ необходимо глубоко знать теоретические основы электролиза и уметь применять эти знания на практике. Важно уметь работать с формулами и уравнениями, анализировать данные и применять соответствующие методы решения. Такой подход поможет решить задания эффективно и точно.
Вопрос-ответ

Что такое электролиз?
Электролиз - это процесс, при котором разложение вещества происходит под действием электрического тока. В результате электролиза происходит разделение вещества на ионы и его превращение в другие вещества.
Какие основные принципы лежат в основе электролиза?
Основными принципами электролиза являются проведение электрического тока через электролит, наличие двух электродов (катода и анода) и реакции окисления и восстановления на электродах. Катод притягивает положительные ионы, где происходит восстановление, а анод притягивает отрицательные ионы, где происходит окисление.
Какие металлы можно получить с помощью электролиза?
С помощью электролиза можно получить широкий спектр металлов, начиная от алюминия и заканчивая металлами редкоземельной группы. Например, алюминий получают методом электролиза расплавленного алюминия, а медь - электролизом раствора медного купороса.
Какова роль электролита в процессе электролиза?
Электролит играет важную роль в процессе электролиза. Он является веществом, способным проводить электрический ток, и разлагается на ионы под действием электрического тока. Ионы электролита мигрируют к соответствующим электродам и участвуют в окислительно-восстановительных реакциях.
Как электролиз применяется в промышленности?
Электролиз используется в промышленности для получения металлов, очистки и обработки различных веществ, производства электролитического гальванического покрытия, а также для производства водорода и кислорода.
