Электролиз водного раствора металла является эффективным методом получения чистого металла из его соли. Этот процесс основан на применении электрического тока для разложения молекул металлической соли на ионы металла и ионы гидроксида. Полученные ионы металла мигрируют к катоду, где осаждается чистый металл, а ионы гидроксида реагируют с водой, образуя газ.
Электролиз водного раствора металла имеет широкое применение в промышленности. Он используется для получения металлов, таких как медь, никель, цинк и алюминий. Этот процесс позволяет получить металлы высокой степени чистоты, что особенно важно в производстве электроники, медицинского оборудования и других высокотехнологичных изделий.
Одним из преимуществ электролиза водного раствора металла является возможность переработки отходов и вторичных сырьевых материалов. Использование этого процесса позволяет эффективно извлекать металлы из отходов и использовать их повторно. Таким образом, электролиз способствует снижению экологического воздействия промышленности и уменьшению потребности в добыче природных ресурсов.
Важно отметить, что электролиз водного раствора металла требует энергозатрат. Поэтому разработка и использование эффективных и экологически чистых методов получения металлов является актуальной задачей для научного сообщества и промышленности.
В заключение, электролиз водного раствора металла представляет собой важный процесс получения чистого металла из его соли. Он находит широкое применение в промышленности и способствует переработке отходов. Более эффективные и экологически чистые методы электролиза являются одной из задач научного и промышленного развития.
Процесс электролиза водного раствора металла

Электролиз водного раствора металла является эффективным методом получения чистого металла из его соли. Этот процесс основан на применении постоянного электрического тока, который приводит к разложению металлической соли на ионы металла и ионы гидроксида или кислоты.
Перед проведением электролиза необходимо подготовить раствор металлической соли, который может быть получен путем растворения соответствующего соединения в воде. Затем раствор помещается в электролитическую ячейку, где находятся анод и катод. Анодом служит металлический стержень, обычно выполненный из инертного материала, такого как платина или карбон. Катодом является электрод, на котором будет происходить осаждение металла.
При подаче электрического тока ионы металла двигаются к катоду, где они получают необходимую для осаждения энергию и превращаются в чистый металл. При этом на аноде происходит обратная реакция, и ионы гидроксида или кислоты окисляются, образуя кислород или воду.
Процесс электролиза водного раствора металла может быть использован для получения различных металлов, таких как медь, никель, цинк и другие. Он широко применяется в промышленности для получения чистого металла с высокой степенью чистоты, которое может быть использовано в различных отраслях производства.
Что такое электролиз и как он работает?
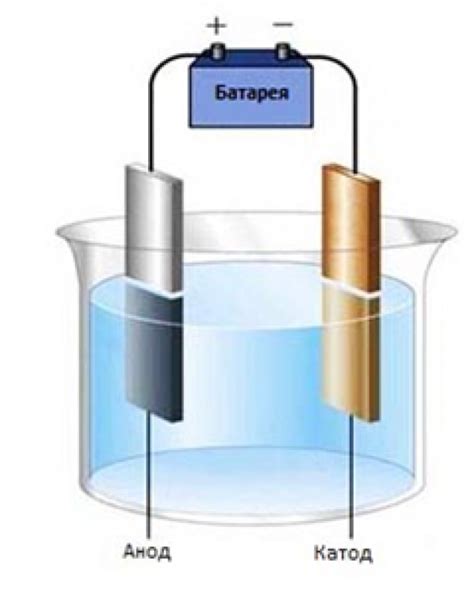
Электролиз – это процесс разложения вещества под воздействием электрического тока. Он осуществляется с помощью электролизера, состоящего из двух электродов, погруженных в раствор или расплав вещества, которое требуется разложить.
Водный раствор металла – один из примеров, где применяется электролиз. В этом процессе вода служит электролитом, а металлическая соль растворяется в ней, образуя положительные и отрицательные ионы.
При подключении электрода к аноду и катоду электролизера, происходит движение электрического тока через раствор. Положительный ион металла, присоединяясь к катоду, осаждается на нем в виде чистого металла, а отрицательный ион аниона освобождается на аноде. Таким образом, происходит разделение соли на чистые компоненты.
Электролиз позволяет получить чистые металлы из их солей, что является важной процессом в металлургической и химической промышленности. Он также используется для разделения смесей и очистки воды.
Выбор металла и его соединения для электролиза
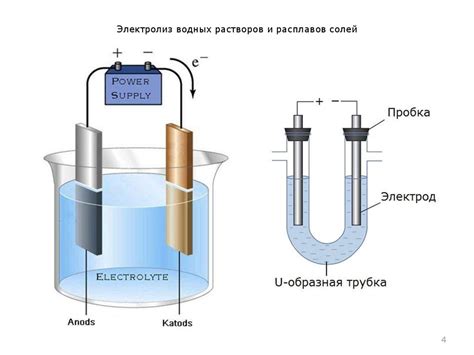
При выборе металла и его соединения для электролиза важно учитывать ряд факторов. В первую очередь, необходимо убедиться в наличии у металла достаточной электрохимической активности. В противном случае, процесс электролиза может быть недостаточно эффективным.
Кроме того, следует обратить внимание на растворимость соединения металла, которое будет использоваться в качестве электролита. Чем легче соединение растворяется в воде, тем эффективнее будет процесс электролиза.
Важным фактором выбора является степень стабильности соединения металла в растворе. Если соединение металла имеет тенденцию к разложению или образованию других соединений, это может привести к неожиданным результатам электролиза и ухудшению качества получаемого металла.
Различные металлы и их соединения могут иметь разную степень электротранспорта и скорость реакций электролиза. Поэтому важно учитывать эти факторы при выборе металла и его соединения для электролиза, чтобы добиться оптимальных результатов.
Для более подробной информации и сравнения различных металлов и их соединений, можно использовать таблицы электрохимических свойств металлов. Эти таблицы содержат данные о потенциале окисления, растворимости и других характеристиках, которые помогут принять правильное решение при выборе металла и его соединения для электролиза.
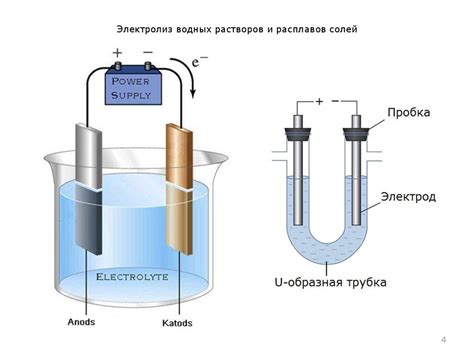
Схема и устройство установки для электролиза водного раствора металла
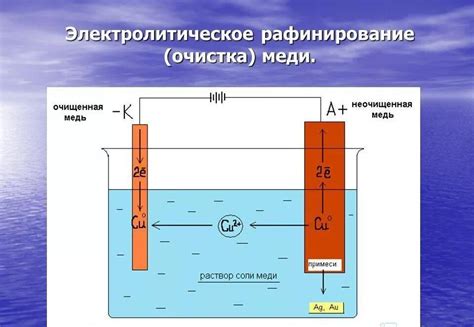
Процесс электролиза водного раствора металла осуществляется с использованием специальной установки, которая состоит из нескольких основных компонентов. Одним из главных элементов установки является электролитическая ячейка, где происходит электролиз раствора. Ячейка имеет форму прямоугольного бака, выполненного из непроводящего материала, такого как стекло или полимеры.
Внутри ячейки находятся два электрода – анод и катод, которые размещены на определенном расстоянии друг от друга. Анод изготавливается из материала, который будет давать ионы металла, а катод обычно изготавливается из платины или другого инертного материала. Между электродами размещается специальная мембрана, которая предотвращает прямое взаимодействие между анодом и катодом.
Для обеспечения электрической силы тока в установке используется источник постоянного электрического тока, обычно представленный батареей или аккумулятором. Ток подается на электроды, что вызывает процесс электролиза – разложения водного раствора металла на ионы и осаждение металла на катоде.
Установка для электролиза водного раствора металла может также включать систему контроля и регулирования параметров процесса, таких как сила тока, время электролиза и концентрация раствора. Это позволяет получить чистый металл с высокой степенью чистоты и качества.
Реакции, происходящие в процессе электролиза

Электролиз водного раствора металла представляет собой способ получения чистого металла из его соли путем применения электрического тока. В процессе электролиза происходит разложение воды на кислород и водород.
Когда в растворе находится металлическая соль, например, медный (II) сульфат, происходит окисление и восстановление вещества. Окисление происходит на положительном электроде (аноде), где идет отрицательный ток, а восстановление - на отрицательном электроде (катоде).
На аноде происходит окисление металлических ионов, например, Cu2+ в Cu2+, при этом ионы меди отдают свои электроны и переходят в атомное состояние. Эти атомы меди соединяются друг с другом и образуют металлическую медь. Таким образом, на аноде происходит процесс электролиза медной соли, при котором получается чистая медь.
На катоде происходит восстановление гидроксильных ионов H+ и OH- из воды. При этом к положительному электроду притягиваются отрицательно заряженные ионы водорода, которые встраиваются в структуру металла, например, в медь. Окружающая вода при этом принимает отрицательный заряд, что приводит к образованию гидроксильных ионов.
Таким образом, в процессе электролиза водного раствора металла происходят реакции окисления и восстановления, которые позволяют получить чистое металлическое вещество из его ионов в растворе. Этот метод является важным способом получения чистого металла и находит широкое применение в различных отраслях промышленности.
Зависимость процесса электролиза от температуры и концентрации раствора
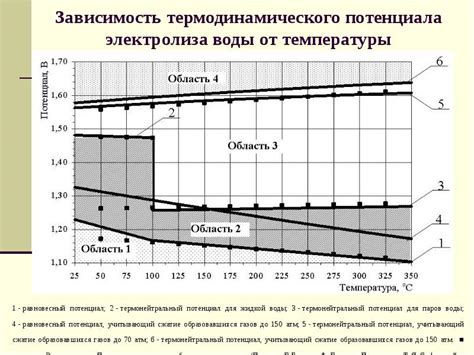
Процесс электролиза водного раствора металла зависит от нескольких факторов, включая температуру и концентрацию раствора. Температура играет важную роль в процессе, так как она влияет на скорость реакции электролиза и энергию, необходимую для проведения процесса.
При повышении температуры в растворе увеличивается скорость движения ионов, что ускоряет процесс электролиза. Тепловая энергия также способствует разрушению ионных связей, что облегчает диссоциацию соли и образование ионов. Следовательно, чем выше температура раствора, тем быстрее происходит электролиз.
Концентрация раствора также влияет на процесс электролиза. При низкой концентрации раствора, количество ионов в растворе будет меньше, что может замедлить процесс электролиза из-за снижения сопротивления раствора. Однако, при высокой концентрации раствора, образование ионов может значительно увеличиться, ускоряя процесс электролиза.
При выборе оптимальной температуры и концентрации раствора для проведения электролиза важно учитывать не только скорость процесса, но и возможные реакции побочных процессов или образование отложений на электродах. Поэтому эти параметры должны быть тщательно подобраны в зависимости от конкретной ситуации и целей проводимых исследований.
Получение чистого металла из его соли с помощью электролиза
Электролиз водного раствора металла является одним из способов получения чистого металла из его соли. Этот процесс основан на использовании электричества для разрушения химических связей воды и металлической соли.
Для проведения электролиза необходимы два электрода: анод и катод. Анодом служит положительно заряженный электрод, а катодом - отрицательно заряженный электрод. Располагая анод и катод в водном растворе металлической соли и подключая их к источнику постоянного тока, можно начать процесс электролиза.
Во время электролиза происходит процесс окисления воды на аноде и процесс восстановления металлического катиона на катоде. В результате на катоде образуется осадок чистого металла, который можно отделить и использовать в дальнейшем.
Процесс электролиза позволяет получить чистый металл без примесей, что делает его эффективным методом для производства качественных металлических изделий. Кроме того, электролиз водного раствора металла является экологически чистым процессом, так как не требует использования химических реагентов и не выделяет вредных веществ.
Перспективы и применение электролиза для получения чистого металла
Электролиз является важным процессом для получения чистого металла из его соли. Он имеет широкий спектр применения в различных отраслях промышленности и научных исследований.
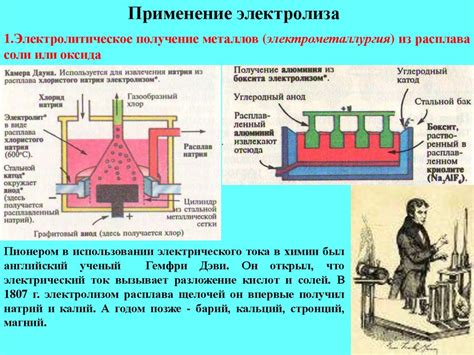
В первую очередь, электролиз используется для производства чистого металла в металлургической промышленности. Этот процесс позволяет получать металл без примесей и других вредных веществ, что делает его более ценным и востребованным на рынке. Кроме того, электролиз позволяет получать металл с заданной степенью чистоты и определенными физическими и химическими свойствами.
В дополнение к металлургии, электролиз находит применение в других отраслях, таких как производство химических веществ и электроники. Например, при производстве хлора и щелочей электролиз используется для разложения солей и получения чистого хлора. В электронике электролиз применяется для получения чистых металлических пленок и проводников, которые являются основными компонентами электронных устройств.
Электролиз также позволяет проводить исследования по изучению свойств различных металлов и солей. Путем изменения условий электролиза, таких как температура, сила тока и состав электролита, можно получать различные формы и структуры металла, а также изучать его физические и химические свойства.
В целом, электролиз является эффективным методом получения чистого металла из его соли. Он имеет широкий спектр применения в различных отраслях промышленности и научных исследований, что делает его важным инструментом для развития и прогресса в области материаловедения и технологий.
Вопрос-ответ

Какие вещества можно получить с помощью электролиза водного раствора металла?
С помощью электролиза водного раствора металла можно получить металл в чистом виде. Например, путем электролиза раствора медного(II) сульфата можно получить чистую медь.
Как происходит электролиз водного раствора металла?
Во время электролиза водного раствора металла происходит разложение воды на катионы и анионы. Катионы, включая металл, перемещаются к катоду, а анионы перемещаются к аноду. На катоде металл восстанавливается в чистом виде. В результате электролиза получается металл в чистом виде, а также газы, такие как кислород и водород.
Какие факторы влияют на эффективность электролиза водного раствора металла?
Эффективность электролиза водного раствора металла зависит от нескольких факторов. Один из них - сила тока, которую можно изменять, чтобы контролировать скорость электролиза. Также важна концентрация металлической соли в растворе, чем выше концентрация, тем быстрее будет проходить процесс электролиза. Еще одним фактором является выбор материала анода и катода, так как разные материалы могут оказывать влияние на химические реакции, происходящие в процессе электролиза.
