Электрохимический ряд активности металлов — это упорядоченная таблица, отражающая их способность участвовать в электрохимических реакциях. Ряд представляет собой список металлов, упорядоченных по возрастанию степени их активности в химических реакциях. Чем выше металл в списке, тем большую активность он проявляет.
В основе электрохимического ряда лежат данные о том, какие металлы способны вытеснять друг друга из своих соединений при проведении электрохимических реакций. Этот ряд был разработан на основе экспериментальных наблюдений и является фундаментальным инструментом для предсказания результатов различных электрохимических процессов.
Электрохимический ряд активности металлов позволяет определить электродные потенциалы различных металлов относительно стандартного водородного электрода (СВЭ). Стандартный водородный электрод имеет нулевой электродный потенциал. Поэтому, зная порядок металлов в электрохимическом ряду, можно предсказать направление и интенсивность электрохимических процессов и возможность их протекания.
В данной статье будут рассмотрены основные принципы построения электрохимического ряда активности металлов, его применение в процессах гальванической коррозии и электролиза, а также некоторые особенности ряда и его значимость в химических и электрохимических исследованиях.
Электрохимический ряд активности металлов

Электрохимический ряд активности металлов - это важное понятие в химии, которое позволяет определить относительную реактивность металлов в химических реакциях. Ряд представляет собой упорядоченный список металлов по степени их активности. Вверху ряда находятся самые активные металлы, которые легко окисляются и вытесняют из растворов соединения менее активные металлы.
Основой для составления электрохимического ряда служат данные экспериментов, где металлы помещают в растворы своих солей и наблюдают за процессом окисления металлов и редукции ионов. Результаты этих экспериментов позволяют установить, какой металл способен активнее выделять металлическое железо из раствора и вытеснять другие металлы.
В электрохимическом ряду активности металлов вверху находятся, например, калий, натрий, литий, которые являются самыми активными металлами и окисляются очень легко даже при взаимодействии с обычным воздухом. Наоборот, внизу ряда находятся металлы, которые окисляются с трудом или вообще не окисляются при обычных условиях.
Знание электрохимического ряда активности металлов является важным при решении различных задач в химии. Например, при выборе материала для анодов и катодов в электрохимических элементах или при проведении электролиза, где важно знать, какой металл окисляется легко, а какой с трудом. Этот ряд также используется для определения, какую металлы легко вытеснить из растворов и провести реакцию замещения.
Основные принципы электрохимического ряда
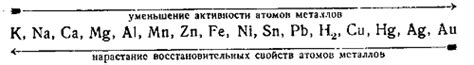
Электрохимический ряд активности металлов – это таблица, в которой представлены различные металлы в порядке убывания их активности. Основные принципы этого ряда позволяют определить главные характеристики каждого металла и его отношение к другим элементам.
Первый принцип состоит в том, что металлы справа в ряду – это активные металлы, они обладают большей способностью к окислению. Следовательно, они будут реагировать с веществами активнее, чем металлы, находящиеся в левой части ряда.
Второй принцип заключается в том, что металлы слева от водорода, который стоит в середине ряда, являются так называемыми "негативными" или "анодными" металлами. Они будут давать электроны и окисляться во время химических реакций. Металлы справа от водорода, считаются "положительными" или "катодными" металлами и будут принимать электроны и восстанавливаться.
Третий принцип заключается в том, что порядок расположения металлов в электрохимическом ряду указывает на возможность всевозможных реакций. Если один металл находится выше в ряду, чем другой, то он может вытеснить его из раствора своей соли. Таким образом, металлы, находящиеся в верхней части ряда, могут вытеснять металлы, находящиеся в нижней части ряда.
Электрохимический ряд активности металлов является важным инструментом для определения химической активности металлов и предсказания их реакционной способности в различных условиях.
Вопрос-ответ

Какие металлы находятся в начале электрохимического ряда активности?
В начале электрохимического ряда активности находятся самые активные металлы, такие как литий, натрий и калий.
Какие металлы находятся в конце электрохимического ряда активности?
В конце электрохимического ряда активности находятся металлы, которые проявляют меньшую активность при реакциях с веществами. К таким металлам относятся свинец, медь и золото.
Какие свойства имеют металлы, находящиеся в начале электрохимического ряда активности?
Металлы, находящиеся в начале электрохимического ряда активности, обладают высокой химической активностью. Они легко вступают в реакции с веществами и часто образуют ионы металла с положительным зарядом.
Какие примеры реакций можно привести, основываясь на электрохимическом ряде активности металлов?
Например, реакция между цинком и серной кислотой – цинк будет давать электроны и станет проигравшим, а серная кислота, наоборот, получает электроны и становится победителем, образуя сернистый газ. Такие реакции позволяют предсказывать, какие металлы смогут образовывать реакции с другими веществами.
